- 1. Taubat A. Makna TaubatMenurut bahasa At-taubah berarti ar-rujuu‟ (kembali), sedangkan menurut istilah taubat adalah kembali darikondisi jauh dari Allah SWT menuju kedekatan kepada-Nya. Atau: pengakuan atas dosa, penyesalan, berhenti,dan tekad untuk tidak mengulanginya kembali di masa datang.Mengapa harus bertaubat?1. Karena manusia pasti berdosa.2. Karena dosa adalah penghalang antara kita dan Sang Kekasih (Allah SWT), maka lari dari hal yang membuatkita jauh dari-Nya adalah kemestian.3. Karena dosa pasti membawa kehancuran cepat atau lambat, maka mereka yang berakal sehat pasti segeramenjauh darinya.4. Jika ada manusia yang tidak melakukan dosa, pasti ia pernah berkeinginan untuk melakukannya. Jika adaorang yang tidak pernah berkeinginan melakukan dosa, pasti ia pernah lalai dari mengingat Allah. Jika ada orangyang tidak pernah lalai mengingat Allah, pastilah ia tidak akan mampu memberikan hak Allah sepenuhnya. Semuaitu adalah kekurangan yang harus ditutupi dengan taubat.5. Karena Allah swt memerintahkan kita bertaubat, sebagaimana dalam firman-Nya,“Hai orang-orang yang beriman, bertaubatlah kepada Allah dengan taubatan nasuhaa (taubat yang semurni-murninya). Mudah-mudahan Rabbmu akan menutupi kesalahan-kesalahanmu dan memasukkanmu ke dalamjannah yang mengalir di bawahnya sungai-sungai, pada hari ketika Allah tidak menghinakan Nabi dan orang-orangmukmin yang bersama dia; sedang cahaya mereka memancar di hadapan dan di sebelah kanan mereka, sambilmereka mengatakan: “Ya Rabb kami, sempurnakanlah bagi kami cahaya kami dan ampunilah kami;Sesungguhnya Engkau Maha Kuasa atas segala sesuatu”. (QS. At-Tahrim: 8)“Dan bertaubatlah kamu sekalian kepada Allah, hai orang-orang yang beriman supaya kamu beruntung.” (QS. An-Nuur: 31)“dan hendaklah kamu meminta ampun kepada Tuhanmu dan bertaubat kepada-Nya. (Jika kamu mengerjakanyang demikian), niscaya Dia akan memberi kenikmatan yang baik (terus menerus) kepadamu sampai kepadawaktu yang telah ditentukan dan Dia akan memberikan kepada tiap-tiap orang yang mempunyai keutamaan(balasan) keutamaannya. Jika kamu berpaling, maka sesungguhnya aku takut kamu akan ditimpa siksa harikiamat.” (QS. Huud: 3)6. Karena Allah mencintai orang yang bertaubat, sebagaimana dalam firman-Nya,
- 2. “Sesungguhnya Allah menyukai orang-orang yang bertaubat dan menyukai orang-orang yang mensucikandiri.” (QS. Al-Baqarah: 222)7. Karena Rasulullah SAW senantiasa bertaubat padahal beliau seorang nabi yang ma‟shum (terjaga dari dosa).Beliau bersabda:“Demi Allah, sesungguhnya aku meminta ampun dan bertaubat kepada Allah dalam sehari lebih dari tujuh puluhkali.” (HR. Bukhari).Dalam riwayat Muslim disebutkan bahwa beliau beristighfar seratus kali dalam sehari.Syarat-syarat taubat 1. Penyesalan dari dosa karena Allah. 2. Berhenti melakukannya. 3. Bertekad untuk tidak mengulanginya di masa datang. 4. Dilakukan sebelum nyawa sampai di tenggorokan ketika sakaratul maut, atau sebelum matahari terbit dari barat. 5. Jika dosa berkaitan dengan sesama manusia, maka syaratnya bertambah satu: melunasi hak orang tersebut, atau meminta kerelaannya, atau memperbanyak amal kebaikan.Kemaksiatan yang dilakukan berkaitan dengan hak sesama manusia, ada empat syarat yang harus dipenuhi, yaknisyarat pertama, kedua, dan ketiga, sebagaimana tiga syarat di atas, dan syarat keempat: membebaskan diri darihak tersebut.Artinya, jika hak itu berupa harta benda, ia harus mengembalikan kepada pemiliknya. Jikaberupa qadzaf (menuduh orang lain berbuat zina), ia harus menyerahkan dirinya untuk dijatuhi hukuman ataumeminta maaf kepada orang yang bersangkutan. Jika berupa ghibah (menggunjing orang lain), ia harus memintamaaf kepada orang tersebut.Setiap orang harus bertaubat dari segala dosa yang pernah diperbuat. Jika ia hanya bertaubat dari sebagiandosanya, taubat tersebut diterima, namun ia masih mempunyai tanggungan dosa yang lain. B. Buah dari TaubatTaubat selain kewajiban dan keharusan yang mesti dilakukan oleh manusia, tanpa terkecuali orang berimanapalagi orang banyak berdosa dan maksiat. Allah SWT berfirman“…dan bertaubatlah kamu sekalian kepada Allah, hai orang-orang yang beriman supaya kamu beruntung.” (QS.An-Nuur: 31)Allah Berfirman:“Mohonlah ampun kepada Tuhanmu kemudian bertaubatlah kepada-Nya…” (QS. Huud: 90)Allah Berfirman:“Hai orang-orang yang beriman, bertaubatlah kepada Allah dengan taubat yang sesungguhnya…” (QS. At-Tahrim:8)
- 3. Dalam hadits nabi disebutkan:Abu Hurairah RA berkata: “Aku mendengar Rasulullah SAW bersabda, „Demi Allah, sesungguhnya, aku membacaistighfar dan bertaubat kepada Allah dalam sehari lebih dari tujuh puluh kali.‟”(HR. Bukhari)Dalam riwayat lain disebutkan:Al-Aghar bin Yasar Al-Muzani RA berkata bahwa Rasulullah SAW bersabda, “Hai manusia, bertaubatlah kepadaAllah dan mintalah ampunan kepada-Nya. Sesungguhnya, aku bertaubat seratus kali dalam sehari.” (HR. Muslim)Taubat juga merupakan amalan yang sangat disenangi dan dicintai oleh Allah SWT. Seperti firman Allah:“Sesungguhnya Allah mencintai orang yang bertaubat dan mencintai orang yang mensucikan diri” (QS. Al-Baqarah: 222)Kegembiraan dan kesenangan Allah begitu besar seperti orang yang mendapatkan barang yang sebelumnya hilangnamun secara tiba-tiba ada dihadapannya, Rasulullah saw mentamsilkan dalam haditsnya:Abu Hamzah, Anas bin Malik Al-Ansari RA (pelayan Rasulullah SAW.) berkata bahwa Rasulullah SAWbersabda: “Allah lebih gembira terhadap taubat hamba-Nya daripada seseorang di antara kamu yangmendapatkan untanya yang telah hilang di gurun sahara.” (Muttafaq „alaih)Dalam riwayat lain disebutkan: “Allah sangat gembira terhadap hamba-Nya yang mau bertaubat. KegembiraanAllah itu lebih besar daripada kegembiraan seseorang di antara kamu yang mendapatkan kembali untanya yangsarat dengan perbekalan. Sebelumnya, ia mengendarai untanya di gurun sahara, lalu unta yang a tunggangilepas. Padahal, di atas unta tersebut terdapat makanan dan minuman perbekalannya. Ia sudah putus asa.Kemudian, ia mendekati sebuah pohon, dan berbaring di bawahnya. Dia sudah yakin bahwa untanya tidak akankembali. Pada saat itulah, tiba-tiba unta tersebut berdiri di depannya. Ia memegang kendalinya. Lalu karenasangat gembiranya, ia mengucapkan, „Ya Allah, Engkau adalah hambaku dan aku adalah tuhan-Mu.‟ Ia salahmengucapkannya karena sangat gembira.” (HR. Muslim)
- 4. Dalam hadits disebutkan:Abu Hurairah RA berkata bahwa Rasulullah SAW bersabda, “Allah SWT tertawa melihat dua orang yang inginsaling membunuh, tetapi keduanya masuk surga.”Para sahabat bertanya, “Ya Rasulullah, bagaimana itu bisa terjadi?”(Rasulullah menjawab), “Orang yang pertama berperang di jalan Allah, lalu ia terbunuh sebagai syahid. Kemudian,si pembunuh bertaubat dan masuk Islam. Ia berperang di jalan Allah hingga mati sebagai syahid.” (Muttafaq„alaih)Di samping itu pula Allah akan menggantikan keburukan dengan kebaikan, sebagaimana firman-Nya:“Kecuali orang yang bertaubat, beriman dan melakukan perbuatan baik; maka kejahatan mereka diganti dengankebajikan. Dan adalah Allah Maha Pengampun lagi Maha Penyayang”. (QS. Al-Furqan: 70)Karena itu taubat bagi kita adalah sebuah kebutuhan agar kita mendapatkan karunia yang begitu dari Allah SWT.Adapun buah dari bertaubat kepada Allah adalah:1. Mendapatkan kecintaan dari Allah SWT.“Sesungguhnya Allah menyukai orang-orang yang bertaubat dan menyukai orang-orang yang mensucikandiri.” (QS. Al-Baqarah: 222)2. Mendapatkan nikmat dari Allah saat di dunia.“… maka aku katakan kepada mereka: „Mohonlah ampun kepada Tuhanmu, -sesungguhnya Dia adalah MahaPengampun-, niscaya Dia akan mengirimkan hujan kepadamu dengan lebat, dan membanyakkan harta dan anak-anakmu, dan mengadakan untukmu kebun-kebun dan mengadakan (pula di dalamnya) untukmu sungai-sungai.” (QS. Nuh: 10-12)3. Dihapuskannya dosa-dosa.
- 5. “Hai orang-orang yang beriman, bertaubatlah kepada Allah dengan taubatan nasuhaa (taubat yang semurni-murninya). Mudah-mudahan Rabbmu akan menutupi kesalahan-kesalahanmu…” (QS. At-Tahrim: 8)4. Mendapatkan ganjaran surga “… dan memasukkanmu ke dalam jannah yang mengalir di bawahnya sungai-sungai…” (QS. At-Tahrim: 8)5. Digantikannya kejahatan dengan kebaikan“… kecuali orang-orang yang bertaubat, beriman dan mengerjakan amal saleh; maka itu kejahatan mereka digantiAllah dengan kebajikan. Dan adalah Allah maha Pengampun lagi Maha Penyayang.” (QS. Al-Furqan: 70)C. Yang Menyebabkan Dosa Kecil Menjadi Besar di Sisi Allah SWT1. Jika dilakukan terus menerusAllah SWT berfirman,“Dan (juga) orang-orang yang apabila mengerjakan perbuatan keji atau menganiaya diri sendiri, mereka ingatakan Allah, lalu memohon ampun terhadap dosa-dosa mereka dan siapa lagi yang dapat mengampuni dosa selaindari pada Allah? Dan mereka tidak meneruskan perbuatan kejinya itu, sedang mereka mengetahui.” (QS. AliImran: 135)Dosa besar yang hanya dilakukan sekali, lebih bisa diharapkan pengampunannya dari pada dosa kecil yangdilakukan terus menerus, jika seorang hamba meremehkannya. Setiap kali seorang hamba menganggap besarsebuah dosa niscaya akan kecil di sisi Allah, dan setiap kali ia menganggap remeh sebuah dosa niscaya akanmenjadi besar di sisiNya.Abdullah bin Mas‟ud RA berkata:“Seorang mukmin memandang dosanya bagaikan gunung yang akan runtuh menimpa dirinya, sedangkan seorangpendosa menganggap dosanya seperti seekor lalat yang mencolok di hidungnya, cukup diusir dengantangannya.” (HR. Bukhari-Muslim).Bilal bin Sa‟ad rahimahullah berkata:“Jangan kamu memandang kecilnya dosa, tapi lihatlah keagungan Zat yang kamu durhakai itu.”2. Jika seseorang melakukan dosa tanpa diketahui orang lain lalu ia menceritakannya dengan banggakepada orang lainJika dilakukan dengan bangga atau minta dipuji, seperti seseorang yang mengatakan: “Lihat, bagaimanahebatnya saya mempermalukan orang itu di depan umum!?” Atau seperti ucapan seorang pedagang: “Lihat,bagaimana saya bisa menipu pembeli itu!?”Rasulullah SAW bersabda:
- 6. “Setiap umatku selamat kecuali orang-orang yang terang-terangan berlaku dosa. Dan di antara perbuatan terang-terangan melakukan dosa ialah jika seseorang berdosa di malam hari sementara Allah telah menutupi aibnya,namun di pagi hari ia merobek tirai penutup itu sambil berkata: “Hai Fulan, semalam aku melakukan ini danitu.” (HR. Bukhari-Muslim).3. Jika yang melakukannya seorang alim yang menjadi panutan.Karena apa yang ia lakukan dicontoh oleh orang lain. Ketika ia melakukan dosa, maka ia juga mendapatkan dosaorang yang mencontohnya. Rasulullah SAW bersabda:“…dan barang siapa memberi contoh keburukan dalam Islam maka baginya dosa perbuatan itu dan juga dosaorang yang mencontohnya setelah itu tanpa dikurangi sedikit pun dosa itu dari pelakunya.” (HR. Muslim).D. Allah Pasti Menerima Taubat Hamba-NyaJangan takut dengan dosa yang pernah kita lakukan karena Allah pasti akan menerima taubat hamba selamadirinya mau datang kepada Allah dan bertaubat kepada-Nya dengan penuh kesungguhan. Ambilah hikmah daribeberapa kisah yang terekam dalam hadits-hadits berikut ini,Abu Sa‟id, Sa‟d bin Malik bin Sinan Al-Khudri RA berkata bahwa Nabi SAW bersabda: “Di kalangan masyarakatsebelum kalian, ada seorang laki-laki yang telah membunuh 99 orang. (Karena ingin bertaubat), ia bertanyakepada seseorang, di mana orang yang paling banyak ilmunya berada? Ia ditunjukkan kepada seorang pendeta,lalu ia mendatangi pendeta itu.Orang yang mengantar berkata (kepada si pendeta), „Ia telah membunuh 99 orang. Apakah ia masih memilikipeluang bertaubat.‟Pendeta itu menjawab, „Tidak.‟(Laki-laki pembunuh itu naik pitam) lalu membunuh si pendeta. Dengan demikian, ia telah membunuh seratusorang.Pembunuh itu bertanya kembali tentang keberadaan orang yang paling banyak ilmunya. Ia ditunjukkan kepadaseorang ulama. (Sesampainya di tempat ulama itu), orang yang mengantar berkata, „Ia telah membunuh seratusorang, apakah masih terbuka pintu taubat baginya?‟
- 7. Ulama itu menjawab, „Ya. Tidak ada yang menghalangi Allah untuk menerima taubat. Berangkatlah ke daerah inidan ini. Di sana ada kaum yang menyembah Allah. Beribadahlah bersama mereka. Jangan kembali kelingkunganmu, karena lingkunganmu adalah lingkungan yang buruk (penuh maksiat).‟Laki-laki itu berangkat (memenuhi nasihat ulama itu). Di tengah perjalanan, ia meninggal dunia.Malaikat rahmat dan malaikat azab bertengkar (memperebutkannya). Malaikat rahmat berkata, „Dia telah datangdalam keadaan bertaubat. Hatinya tertuju kepada Allah (karena itu, dia adalah bagianku).‟Malaikat azab berkata, „Dia belum melakukan kebaikan sedikit pun (karena itu, dia bagianku).‟Kemudian, datanglah seorang malaikat dalam bentuk manusia. Kedua malaikat itu mengangkatnya untuk menjadipenengah.Dia (malaikat penengah) berkata, „Ukurlah jarak dua tanah itu (tanah yang mengarah ke tempat pemberangkatanlaki-laki yang akan bertaubat dan tanah yang akan dituju). Ke manakah dia lebih dekat, maka laki-laki inimiliknya.‟Dua malaikat mengukur tanah tersebut. Setelah itu, diketahui bahwa si pembunuh lebih dekat dengan tanah yangakan ditujunya. Dengan demikian, malaikat rahmatlah yang berhak mengambilnya.” (Muttafaq „alaih)Di dalam riwayat lain disebutkan: “Jarak ke tanah yang akan dituju lebih dekat satu jengkal, maka ia menjadigolongannya.”Di dalam riwayat lain disebutkan: “Allah memerintahkan kepada tanah tempat pemberangkatan untuk menjauhdan memerintahkan kepada tanah tempat tujuan untuk mendekat, lalu berfirman, „Ukurlah keduanya.‟ Merekamendapati bahwa tanah tujuan lebih dekat satu jengkal, maka dosa-dosanya diampuni.‟”Di dalam riwayat lain disebutkan: “Dada orang tersebut mendekat ke arah tanah yang dituju.”Dalam kisah lain disebutkan: –-Dari Abu Nujaid, Imran bin Al-Hushain Al-Khuza‟i RA, menceritakan bahwa seorang wanita dari Juhainah datangmenemui Rasulullah SAW. Wanita itu hamil karena zina. Dia berkata, “Ya Rasulullah, aku berhak menerimahukuman hadd. Tegakkanlah hukuman itu terhadapku.”Rasulullah SAW memanggil walinya dan bersabda, “Jagalah dia dengan baik. Apabila dia telah melahirkan,bawalah ke sini.”Sang wali melaksanakan perintah Rasulullah. Setelah wanita itu melahirkan, wanita itu datang menemui Nabi SAWbersama wanita tersebut.Lalu, Rasulullah SAW memerintahkan agar hukuman hadd dilaksanakan terhadap wanita tersebut. Lalu ia diikat,dengan tetap mengenakan pakaiannya (tidak dilepas). Rasulullah SAW memerintahkan agar wanita itu dirajam.Perintah beliau pun dilaksanakan.
- 8. Setelah dia meninggal dunia, Rasulullah menshalatinya. Umar RA berkata, “Ya Rasulullah, engkau menshalatinya,padahal dia telah berbuat zina?”Rasulullah menjawab, “Sungguh, dia telah bertaubat. Seandainya taubatnya dibagikan kepada tujuh puluhpenduduk Madinah, taubat itu pasti mencukupinya. Apakah kamu menjumpai sesuatu yang lebih utama daripadaseseorang yang mengorbankan dirinya untuk Allah yang Mahamulia lagi Maha Agung.” (HR. Muslim)Dalam hadits disebutkan:Ibnu Abbas RA dan Anas bin Malik RA berkata bahwa Rasulullah SAW bersabda, “Seandainya seseorang sudahmemiliki satu lembah emas, ia ingin memiliki dua lembah emas. Tidak ada yang memenuhi mulutnya, kecualidebu1.Dan, Allah menerima taubat orang yang mau bertaubat.” (Muttafaq „alaih)E. Jangan Menunda-Nunda Taubat!Bersegera bertaubat hanya dilakukan oleh mereka yang berakal sehat. Orang-orang yang menunda taubat ibaratseseorang yang ingin mencabut pohon yang mengganggu, namun karena merasa sulit mencabutnya iamenundanya hingga esok atau lusa, atau minggu depan, atau … tanpa ia sadari bahwa semakin hari akar pohonitu makin menghujam di tanah, sedangkan ia semakin tua dan lemah.Jangan menunda-nunda taubat karena mengandalkan rahmat dan ampunan Allah SWT. Orang seperti itu ibaratseorang laki-laki yang menghabiskan seluruh hartanya dengan sia-sia dan meninggalkan keluarganya dalamkefakiran, lalu ia mengharapkan harta karun datang kepadanya tanpa bekerja. Mungkin harta karun itu ada, tapiorang ini jelas kurang sehat akalnya.Mengapa kita dapat berpikir logis dalam masalah keduniaan namun tidak demikian dalam urusan akhirat?Nabi SAW bersabda:Abu Musa, Abdullah bin Qais Al-Asy‟ari RA berkata bahwa Nabi SAW bersabda: “Allah membentangkan tangan-Nyadi malam hari agar orang yang berbuat keburukan di siang hari bertaubat, dan membentangkan tangan-Nya disiang hari agar orang yang berbuat keburukan di malam hari bertaubat. (Ini akan terus berlaku) hingga matahariterbit dari arah barat.” (HR. Muslim)Abu Hurairah RA berkata bahwa Rasulullah SAW bersabda: “Barangsiapa yang bertaubat sebelum matahari terbitdari arah barat, maka Allah akan menerima taubatnya.” (HR. Muslim)1 Adapun yang dimaksud dengan “Tidak ada yang memenuhi mulutnya, kecuali debu,” dalam hadits ini ialah tidakada yang dapat menghentikan ketamakannya, kecuali kematian.
- 9. Abu Abdirrahman, Abdullah bin Umar bin Khaththab RA berkata bahwa Nabi SAW bersabda: “Allah yangMahamulia dan Maha Agung menerima taubat hamba-Nya selama belum sekarat.”(Tirmidzi. Ia berkata, “Hadits inihasan shahih.”)
- http://www.slideshare.net/syahrulhamid1/taubat#btnNext
Selasa, 20 November 2012
taubat
Sabtu, 13 Oktober 2012
hidup ini semua dari Allah
WIKIPEDIA : Aku tau semuanya.
FACEBOOK : Aku kenal dengan semua orang.
GOOGLE : Aku punya semuanya.
MOZILA : Tanpa aku kalian tidak bisa di akses.
EXPLORER : Kan gue masih ada.
...
FACEBOOK : Aku kenal dengan semua orang.
GOOGLE : Aku punya semuanya.
MOZILA : Tanpa aku kalian tidak bisa di akses.
EXPLORER : Kan gue masih ada.
...
MOZILA : Apaan sih lo, ganggu acara orang aja!
EXPLORER : Lo sih, ngaku-ngaku cuma ada lo sendiri!
INTERNET : Udah-udah! Jangan banyak bacot lo semua, kalo gak ada gue kalian semua gak bakalan ada!
FACEBOOK : Huuu, yang paling sering dikunjungi kan gue, jadi gue yang terbaik.
YAHOO : Facebook, Inget, tanpa gue lo gak bisa buat Email!
GOOGLE : Yahoo, Gue juga bisa buat Email.
INTERNET : zzz... Udah tau gue yg paling hebat :p
KOMPUTER : Gua Paling dewa di sini.
PLN : Bacot lo semua! Gua matiin nih listriknya!
GENSET : tenang aja kan masih ada saya
PLN : diem lu
PERTAMINA : awas kalian semua, saya stop pasokan BBM baru tau rasa lo
SOLAR CELL : tenang kan selama masih ada saya semuanya aman
Matahari : Ettt Gk gw sinarin diem lo
Air, Batubara, Petir dll : MASIH ADA GUA !!!
Bumi : Lo klo gk ada gw pasti gk bakal ada
jagat raya: lo semua kalo gak ada gwe pasti kalian gak bakalan ada....
TUHAN: TANPA SAYA KALIAN SEMUA TIDAK AKAN PERNAH ADA,.
.,.,.,.pada dieemmmm semuaaaa,.,.,.,..
EXPLORER : Lo sih, ngaku-ngaku cuma ada lo sendiri!
INTERNET : Udah-udah! Jangan banyak bacot lo semua, kalo gak ada gue kalian semua gak bakalan ada!
FACEBOOK : Huuu, yang paling sering dikunjungi kan gue, jadi gue yang terbaik.
YAHOO : Facebook, Inget, tanpa gue lo gak bisa buat Email!
GOOGLE : Yahoo, Gue juga bisa buat Email.
INTERNET : zzz... Udah tau gue yg paling hebat :p
KOMPUTER : Gua Paling dewa di sini.
PLN : Bacot lo semua! Gua matiin nih listriknya!
GENSET : tenang aja kan masih ada saya
PLN : diem lu
PERTAMINA : awas kalian semua, saya stop pasokan BBM baru tau rasa lo
SOLAR CELL : tenang kan selama masih ada saya semuanya aman
Matahari : Ettt Gk gw sinarin diem lo
Air, Batubara, Petir dll : MASIH ADA GUA !!!
Bumi : Lo klo gk ada gw pasti gk bakal ada
jagat raya: lo semua kalo gak ada gwe pasti kalian gak bakalan ada....
TUHAN: TANPA SAYA KALIAN SEMUA TIDAK AKAN PERNAH ADA,.
.,.,.,.pada dieemmmm semuaaaa,.,.,.,..
Senin, 01 Oktober 2012
Pengaruh Katalis terhadap Energi Aktivasi
Katalis merupakan suatu zat yang memiliki kemampuan untuk membantu
jalannya suatu reaksi kimia, namun katalis sendiri tidak bereaksi
bersama sama dengan reaksi kimia tersebut. Jumlah katalis pada awal dan
akhir reaksi akan tetap sama.
Sedangkan energi aktivasi sendiri adalah energi minimum yang harus dicapai oleh suatu senyawa kimia untuk melakukan atau bereaksi secara kimia.
Lalu apa hubungan antara energi aktivasi, katalis, dan jalannya suatu reaksi kimia itu sendiri ?
Suatu reaksi kimia akan berlangsung apabila terjadi tumbukan – tumbukan antar partikel dengan energi yang cukup, energi inilah yang disebut dengan energi aktivasi. Tidak semua partikel – partikel pada senyawa kimia dapat bereaksi satu sama lain, hanya partikel – partikel yang memiliki energi aktivasi yang cukup sajalah yang dapat melakukan reaksi, sebagian besar partikel – partikel tersebut tidak memiliki energi aktivasi yang cukup. Nah, untuk kondisi seperti ini diperlukan suatu zat yang memungkinkan semua partikel mencapai energi aktivasinya agar dapat bereaksi satu sama lain, agar laju reaksi menjadi lebih besar. Penambahan katalis sangat diperlukan pada kondisi yang seperti ini, penambahan katalis memberikan perubahan yang berarti pada energi aktivasi. Katalis menyediakan rute khusus untuk jalannya suatu reaksi, jalur khusus ini memiliki energi aktivasi yang rendah, sehingga dapat meningkatkan tumbukan – tumbukan antar partikel. Akibatnya laju reaksi menjadi lebih besar.
tapi perlu diingat katalis hanya mempengaruhi laju pencapaian kesetimbangan, bukan posisi kesetimbangan (membalikkan reaksi). Katalis tidak mengganggu gugat hasil suatu reaksi kesetimbangan dan konsentrasi atau massanya setelah dan sesudah reaksi tetap sama.
Sedangkan energi aktivasi sendiri adalah energi minimum yang harus dicapai oleh suatu senyawa kimia untuk melakukan atau bereaksi secara kimia.
Lalu apa hubungan antara energi aktivasi, katalis, dan jalannya suatu reaksi kimia itu sendiri ?
Suatu reaksi kimia akan berlangsung apabila terjadi tumbukan – tumbukan antar partikel dengan energi yang cukup, energi inilah yang disebut dengan energi aktivasi. Tidak semua partikel – partikel pada senyawa kimia dapat bereaksi satu sama lain, hanya partikel – partikel yang memiliki energi aktivasi yang cukup sajalah yang dapat melakukan reaksi, sebagian besar partikel – partikel tersebut tidak memiliki energi aktivasi yang cukup. Nah, untuk kondisi seperti ini diperlukan suatu zat yang memungkinkan semua partikel mencapai energi aktivasinya agar dapat bereaksi satu sama lain, agar laju reaksi menjadi lebih besar. Penambahan katalis sangat diperlukan pada kondisi yang seperti ini, penambahan katalis memberikan perubahan yang berarti pada energi aktivasi. Katalis menyediakan rute khusus untuk jalannya suatu reaksi, jalur khusus ini memiliki energi aktivasi yang rendah, sehingga dapat meningkatkan tumbukan – tumbukan antar partikel. Akibatnya laju reaksi menjadi lebih besar.
tapi perlu diingat katalis hanya mempengaruhi laju pencapaian kesetimbangan, bukan posisi kesetimbangan (membalikkan reaksi). Katalis tidak mengganggu gugat hasil suatu reaksi kesetimbangan dan konsentrasi atau massanya setelah dan sesudah reaksi tetap sama.
Laju Reaksi dan Kesetimbangan Kimia ( SMA kls.2 )
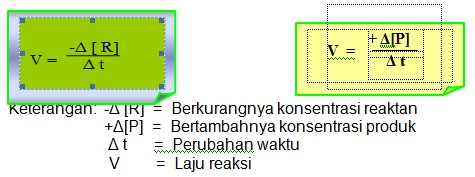
a) Laju Reaksi adalah berkurangnya jumlah pereaksi untuk satuan waktu
atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu.
Ukuran jumlah zat dalam reaksi kimia umumnya dinyatakan sebagai konsentrasi molar atau molaritas (M), dengan demikian maka laju reaksi menyatakan berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi zat hasil reaksi setiap satu satuan waktu (detik). Satuan laju reaksi dinyatakan dalam satuan mol dmˉ³ detˉ¹ atau mol /liter detik.
b) Stoikiometri laju reaksi
Secara umum untuk reaksi yang dinyatakan dengan persamaan reaksi :
aA + bB → cC + dD
Berlaku :
Laju reaksi = Ι Δ [A] = – Ι Δ [B] = + Ι Δ [C] = + Ι Δ [B]
a Δt bΔt cΔt dΔt
c) Penentuan Laju Reaksi
Penentuan laju reaksi dapat dilakukan dengan cara fisika atau cara kimia. Dengan cara fisika yaitu berdasarkan sifat-sifat fisis campuran yang dipengaruhi oleh konsentrasi campuran , misalnya daya hantar listrik, tekanan (untuk reaksi gas),adopsi cahaya dll.
Sedangkan dengan cara kimia yaitu dengan menghentikan reaksi secara tiba-tiba setelah selang waktu tertentu, kemudian konsentrasinya ditentukan dengan metode analisis kimia.
Laju rata-rata = - Δ [Br 2]
Δt
= - [Br2] akhir- [Br2] mula-mula
t akhir- t awal
* Hukum Laju Reaksi
Dari hasil percobaan-percobaan diketahui bahwa umumnya laju reaksi tergantung pada konsentrasi awal dari zat-zat pereaksi, pernyataan ini dikenal dengan Hukum Laju Reaksi atau persamaan laju reaksi.
Secara umm untuk reaksi :
рA + qB → rC
v = k [A]…. [ B ]…..
Keterangan :
V = Laju reaksi ( mol dm ˉ³ det ˉ¹ )
K = Tetapan Laju Reaksi
m = Tingkat reaksi ( orde reaksi ) terhadap A
n = Tingkat reaksi ( orde reaksi ) terhadap B
[ A ]= Konsentrasi awal A (mol dm )
[ B ]= Konsentrasi awal B ( mol dm )
* Faktor-faktor yang mempengaruhi laju reaksi
1). Teori tumbukan.
2). Konsentrasi
3). Luas permukaan sentuhan.
4). Suhu……..laju reaksi
5). Katalisator.
Ada 2 cara yang dilakukan katalisator dalam mempercepat reaksi yaitu.
a). Pembentukan senyawa antara
b). Adsopsi.
“KESETIMBANGAN KIMIA”
A. Reaksi berkesudahan dan dapat balik
Reaksi kimia berdasarkan arahnya dapat dibedakan menjadi dua, yaitu Reaksi berkesudahan satu arah dan dapat balik ( dua arah ). Pada reaksi berkesudahan zat-zat hasil tidak dapat saling bereaksi kembali menjadizat pereaksi. Reaksi kesetimbangan dinamis dapat terjadi bila reaksi yang terjadi merupakan reaksi bolak-balik.
A. Keadaan setimbang.
1). Reaksi bolak-balik.
Suatu reaksi dapat menjadi kesetimbangan bila reaksi baliknya dapat dengan mudah berlangsung secara bersamaan. Proses penguapan dan pengembunan dapat berlangsung dalam waktu bersamaan. Reaksi-reaksi homogen ( Fasa pereaksi dan hasil reaksi sama, misalnya reaksi-reaksi gas atau larutan ) akan lebih mudah berlangsung bolak-balik dibanding dengan reaksi yang Heterogen. Umumnya reaksi heterogen dapat berlangsung bolak-balik pada suhu tinggi.
2). Sistem tertutup
Sistem tertutup adalah suatu sistem reaksi dimana baik zat-zat yang bereaksi maupun zat-zat hasil reaksi tidak ada yang meninggalkan sistem
3). Bersifat dinamis.
Artinya secara mikroskopis berlangsung terus menerus dalam dua arah dengan laju reaksi pembentukan sama dengan laju reaksi baliknya.
A. Hukum kesetimbangan …… tetapan kesetimbangan ( K )
Rumus :…………………………..
Rumusan itu disebut Hukum kesetimbangan, yaitu :
Bila dalam keadaan setimbang maka hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefesiennya dibagi dengan hasil kali konsentrasi zat-zat pareaksi dipangkatkan koefisiennya akan mempunyai harga yang tetap.
a. Makna Harga Tetapan Kesetimbangan.
1). Dapat mengetahui kondisi suatu reaksi bolak balik
2). Dapat mengetahui komposisi zat-zat dalam keadaan setimbang.
a. Harga tetapan kesetimbangan …….. tekanan gas.
Harga tetapan kesetimbangan yang diperoleh berdasarkan konsentrasi diberi lambang Kc, sedangkan untuk tetapan kesetimbangan yang diperoleh dari harga tekanan lambang Kp.
Untuk reaksi setimbang :
Kp = ( Pc )…..( Pd )………
( Pa )…( Pb )…….
Keterangan :
PA : Tekanan Parsial gas A
PB : Tekanan Parsial gas B
PC : Tekanan Parsial gas C
PD : Tekanan Parsial gas D
Berdasarkan Hukum tantang gas ideal PV = n RT dapat dicari hubungan antara Kp dengan Kc
Rumus:…………………..
Sedangkan berdasarkan persamaan gas ideal PV = n RT didapatkan bahwa P = n / v ( RT ) untuk gas besaran n / v adalah merupakan konsentrasi gas dalam ruangan sehingga :
Kp = Kc ( RT )………………………..
Atau
Kp = Kc ( RT ) ……
c). Tetapan kesetimbangan untuk kesetimbangan Heterogen.
Zat-zat yang konsentrasi tetap ( zat padat atau zat cair murni ) tidak tampak pada rumusan harga K
d). Kesetimbangan Disosiasi
Yaitu kasetimbangan yang melibatkan terurainya suatu zat manjadi zat yang lebih sederhana.
e). Pergeseran kesetimbangan
Dikenal dengan Asas Le chatelier yaitu jika dalam suatu sistem kesetimbangan diberi aksi, maka sistem akan berubah sedemikian rupa sehingga pengaruh aksi sekecil mungkin.
Beberapa aksi yang dapat menimbulkan perubahan pada sistem kesetimbangan, antara lain :
- Perubahan konsentrasi
- Perubahan volum
- Perubahan tekanan
- Perubahan suhu.
Ukuran jumlah zat dalam reaksi kimia umumnya dinyatakan sebagai konsentrasi molar atau molaritas (M), dengan demikian maka laju reaksi menyatakan berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi zat hasil reaksi setiap satu satuan waktu (detik). Satuan laju reaksi dinyatakan dalam satuan mol dmˉ³ detˉ¹ atau mol /liter detik.
b) Stoikiometri laju reaksi
Secara umum untuk reaksi yang dinyatakan dengan persamaan reaksi :
aA + bB → cC + dD
Berlaku :
Laju reaksi = Ι Δ [A] = – Ι Δ [B] = + Ι Δ [C] = + Ι Δ [B]
a Δt bΔt cΔt dΔt
c) Penentuan Laju Reaksi
Penentuan laju reaksi dapat dilakukan dengan cara fisika atau cara kimia. Dengan cara fisika yaitu berdasarkan sifat-sifat fisis campuran yang dipengaruhi oleh konsentrasi campuran , misalnya daya hantar listrik, tekanan (untuk reaksi gas),adopsi cahaya dll.
Sedangkan dengan cara kimia yaitu dengan menghentikan reaksi secara tiba-tiba setelah selang waktu tertentu, kemudian konsentrasinya ditentukan dengan metode analisis kimia.
Laju rata-rata = - Δ [Br 2]
Δt
= - [Br2] akhir- [Br2] mula-mula
t akhir- t awal
* Hukum Laju Reaksi
Dari hasil percobaan-percobaan diketahui bahwa umumnya laju reaksi tergantung pada konsentrasi awal dari zat-zat pereaksi, pernyataan ini dikenal dengan Hukum Laju Reaksi atau persamaan laju reaksi.
Secara umm untuk reaksi :
рA + qB → rC
v = k [A]…. [ B ]…..
Keterangan :
V = Laju reaksi ( mol dm ˉ³ det ˉ¹ )
K = Tetapan Laju Reaksi
m = Tingkat reaksi ( orde reaksi ) terhadap A
n = Tingkat reaksi ( orde reaksi ) terhadap B
[ A ]= Konsentrasi awal A (mol dm )
[ B ]= Konsentrasi awal B ( mol dm )
* Faktor-faktor yang mempengaruhi laju reaksi
1). Teori tumbukan.
2). Konsentrasi
3). Luas permukaan sentuhan.
4). Suhu……..laju reaksi
5). Katalisator.
Ada 2 cara yang dilakukan katalisator dalam mempercepat reaksi yaitu.
a). Pembentukan senyawa antara
b). Adsopsi.
“KESETIMBANGAN KIMIA”
A. Reaksi berkesudahan dan dapat balik
Reaksi kimia berdasarkan arahnya dapat dibedakan menjadi dua, yaitu Reaksi berkesudahan satu arah dan dapat balik ( dua arah ). Pada reaksi berkesudahan zat-zat hasil tidak dapat saling bereaksi kembali menjadizat pereaksi. Reaksi kesetimbangan dinamis dapat terjadi bila reaksi yang terjadi merupakan reaksi bolak-balik.
A. Keadaan setimbang.
1). Reaksi bolak-balik.
Suatu reaksi dapat menjadi kesetimbangan bila reaksi baliknya dapat dengan mudah berlangsung secara bersamaan. Proses penguapan dan pengembunan dapat berlangsung dalam waktu bersamaan. Reaksi-reaksi homogen ( Fasa pereaksi dan hasil reaksi sama, misalnya reaksi-reaksi gas atau larutan ) akan lebih mudah berlangsung bolak-balik dibanding dengan reaksi yang Heterogen. Umumnya reaksi heterogen dapat berlangsung bolak-balik pada suhu tinggi.
2). Sistem tertutup
Sistem tertutup adalah suatu sistem reaksi dimana baik zat-zat yang bereaksi maupun zat-zat hasil reaksi tidak ada yang meninggalkan sistem
3). Bersifat dinamis.
Artinya secara mikroskopis berlangsung terus menerus dalam dua arah dengan laju reaksi pembentukan sama dengan laju reaksi baliknya.
A. Hukum kesetimbangan …… tetapan kesetimbangan ( K )
Rumus :…………………………..
Rumusan itu disebut Hukum kesetimbangan, yaitu :
Bila dalam keadaan setimbang maka hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefesiennya dibagi dengan hasil kali konsentrasi zat-zat pareaksi dipangkatkan koefisiennya akan mempunyai harga yang tetap.
a. Makna Harga Tetapan Kesetimbangan.
1). Dapat mengetahui kondisi suatu reaksi bolak balik
2). Dapat mengetahui komposisi zat-zat dalam keadaan setimbang.
a. Harga tetapan kesetimbangan …….. tekanan gas.
Harga tetapan kesetimbangan yang diperoleh berdasarkan konsentrasi diberi lambang Kc, sedangkan untuk tetapan kesetimbangan yang diperoleh dari harga tekanan lambang Kp.
Untuk reaksi setimbang :
Kp = ( Pc )…..( Pd )………
( Pa )…( Pb )…….
Keterangan :
PA : Tekanan Parsial gas A
PB : Tekanan Parsial gas B
PC : Tekanan Parsial gas C
PD : Tekanan Parsial gas D
Berdasarkan Hukum tantang gas ideal PV = n RT dapat dicari hubungan antara Kp dengan Kc
Rumus:…………………..
Sedangkan berdasarkan persamaan gas ideal PV = n RT didapatkan bahwa P = n / v ( RT ) untuk gas besaran n / v adalah merupakan konsentrasi gas dalam ruangan sehingga :
Kp = Kc ( RT )………………………..
Atau
Kp = Kc ( RT ) ……
c). Tetapan kesetimbangan untuk kesetimbangan Heterogen.
Zat-zat yang konsentrasi tetap ( zat padat atau zat cair murni ) tidak tampak pada rumusan harga K
d). Kesetimbangan Disosiasi
Yaitu kasetimbangan yang melibatkan terurainya suatu zat manjadi zat yang lebih sederhana.
e). Pergeseran kesetimbangan
Dikenal dengan Asas Le chatelier yaitu jika dalam suatu sistem kesetimbangan diberi aksi, maka sistem akan berubah sedemikian rupa sehingga pengaruh aksi sekecil mungkin.
Beberapa aksi yang dapat menimbulkan perubahan pada sistem kesetimbangan, antara lain :
- Perubahan konsentrasi
- Perubahan volum
- Perubahan tekanan
- Perubahan suhu.
contoh penerapan laju reaksi dalam kehidupan sehari - hari
1. Laju reaksi itu sgt berkaitan erat dgn luas bidang permukaan....ni contoh penerapan na:
-Ibu di rumah atau pedagang bubur kacang mengiris terlebih dahulu gula merah yang akan di masukan ke dalam bubur kacang.
-Penduduk pedesaan membelah kayu gelondongan menjadi beberapa bagian sebelum dimasukkan ke dalam tungku perapian.
-Penjual gado-gado, lontong, dan pecel terlebih dulu menggerus kacang goreng sebelum dicampurkan dengan bahanain.
-Dalam pembuatan kertas, bahan baku pembuat kertas digerus terlebih dahulu untuk membuat bubur kertas. Agar memperluas pemukaan bidang sentuh sehingga campuran menjadi homogen danreaksi berlangsung sempurna.
-Bahan baku yang sering di tambang, tersedia dalam bentuk butir-butiran kasar. Untuk mempercepat pengolahan selanjutnya, butiran-butiran tersebut dihancurkan sampai halus.
2. Selain itu, laju reaksi jg erat hubungan na sm katalis..tw kn?zat yg bs mmpercepat laju reaksi, tp zat itu sendiri tdk bereaksi...nah, biasanya konsep ini di pake buat industri kayak:
A. INDUSTRI PEMBUATAN AMONIA
Amonia meruapakan zat kimia yang digunakan sebagai bahan baku pada pupuk dan pabrik peledak.
Pada sushu kamar (25 C) reaksi berlangsung lambat. Untuk mempercepatnya harus menggunakan katalis.
Katalis ini ditemukan oleh ahli kimia Jerman, Fritz Haber pada 1905. sehingga proses ini dinamakan Proses Haber.
katalis yang digunakan adalah logam besi yang merupakan katalis heterogen.
B. HHMMM...INDUSTRI PEMBUATAN ASAM NITRAT
-Metode yang sering digunakan dalam industri asam nitrat adalah metode Proses Ostwald, yang dikembangkan oleh ahli kimia Jerman, Wilhelm Ostwald.
-Bahan baku industri asam nitrat adalah amonia. Mula-mula, amonia dibakar pada suhu 800 C.
-Oksida NO terbentuk teroksida dengan cepat membentuk NO .
-Kemudian gas NO diserap oleh air menghasilkan asam nitrit dan asam nitrat.
HNO diubah mnjadi HNO (g) melalui persamaan,
-Gas NO dimasukan kembali ke dalam reaktor dan dioksidasi menjadi NO .
C. INDUSTRI PERMINYAKAN....
-Kebutuhan akan bensin meningkat seiring dengan meningkatnya jumlah kendaraan bermotor, Itulah sebabnya perlu dilakukan pengembangan metode distilasi yang menghasilkan bensin.
-Metode yang dikembangkan tersebut, yaitu pemecahan katalis dan alkilasi.
-Katalis yang digunakan, diantaranya asam, oksida alumunium, silikon, dan krom.
D. INDUSTRI ROTI...yummyyy...
-Katalis yang digunakan dalam pembuatan roti adalah enzim zimase yang merupakan bio katalis.
-Penambahan zimase dilakukan pada proses peragian pengembangan roti.
-Ragi di tambahkan ke dalam adonan sehingga glukosa dalam adonanterurai menjadi etil alkohol dan karbon dioksida.
-Penguraian berlangsung dengan bantuan enzim zimase yang dihasilkan ragi.
-Pada proses ini, CO berfungsi mengembangkan adonan roti.
-Banyaknya rongga kecil pada roti membuktikan terjadinya gelembung CO saat peragian.
-Ibu di rumah atau pedagang bubur kacang mengiris terlebih dahulu gula merah yang akan di masukan ke dalam bubur kacang.
-Penduduk pedesaan membelah kayu gelondongan menjadi beberapa bagian sebelum dimasukkan ke dalam tungku perapian.
-Penjual gado-gado, lontong, dan pecel terlebih dulu menggerus kacang goreng sebelum dicampurkan dengan bahanain.
-Dalam pembuatan kertas, bahan baku pembuat kertas digerus terlebih dahulu untuk membuat bubur kertas. Agar memperluas pemukaan bidang sentuh sehingga campuran menjadi homogen danreaksi berlangsung sempurna.
-Bahan baku yang sering di tambang, tersedia dalam bentuk butir-butiran kasar. Untuk mempercepat pengolahan selanjutnya, butiran-butiran tersebut dihancurkan sampai halus.
2. Selain itu, laju reaksi jg erat hubungan na sm katalis..tw kn?zat yg bs mmpercepat laju reaksi, tp zat itu sendiri tdk bereaksi...nah, biasanya konsep ini di pake buat industri kayak:
A. INDUSTRI PEMBUATAN AMONIA
Amonia meruapakan zat kimia yang digunakan sebagai bahan baku pada pupuk dan pabrik peledak.
Pada sushu kamar (25 C) reaksi berlangsung lambat. Untuk mempercepatnya harus menggunakan katalis.
Katalis ini ditemukan oleh ahli kimia Jerman, Fritz Haber pada 1905. sehingga proses ini dinamakan Proses Haber.
katalis yang digunakan adalah logam besi yang merupakan katalis heterogen.
B. HHMMM...INDUSTRI PEMBUATAN ASAM NITRAT
-Metode yang sering digunakan dalam industri asam nitrat adalah metode Proses Ostwald, yang dikembangkan oleh ahli kimia Jerman, Wilhelm Ostwald.
-Bahan baku industri asam nitrat adalah amonia. Mula-mula, amonia dibakar pada suhu 800 C.
-Oksida NO terbentuk teroksida dengan cepat membentuk NO .
-Kemudian gas NO diserap oleh air menghasilkan asam nitrit dan asam nitrat.
HNO diubah mnjadi HNO (g) melalui persamaan,
-Gas NO dimasukan kembali ke dalam reaktor dan dioksidasi menjadi NO .
C. INDUSTRI PERMINYAKAN....
-Kebutuhan akan bensin meningkat seiring dengan meningkatnya jumlah kendaraan bermotor, Itulah sebabnya perlu dilakukan pengembangan metode distilasi yang menghasilkan bensin.
-Metode yang dikembangkan tersebut, yaitu pemecahan katalis dan alkilasi.
-Katalis yang digunakan, diantaranya asam, oksida alumunium, silikon, dan krom.
D. INDUSTRI ROTI...yummyyy...
-Katalis yang digunakan dalam pembuatan roti adalah enzim zimase yang merupakan bio katalis.
-Penambahan zimase dilakukan pada proses peragian pengembangan roti.
-Ragi di tambahkan ke dalam adonan sehingga glukosa dalam adonanterurai menjadi etil alkohol dan karbon dioksida.
-Penguraian berlangsung dengan bantuan enzim zimase yang dihasilkan ragi.
-Pada proses ini, CO berfungsi mengembangkan adonan roti.
-Banyaknya rongga kecil pada roti membuktikan terjadinya gelembung CO saat peragian.
MATERI LAJU REAKSI
Salam jumpa.....
Anak-anak…..sekarang kita akan belajar tentang laju reaksi kimia…….
meskipun ibu tak bersama kalian, namun melalui blog Pembelajaran ini, kalian dapat belajar mandiri….
Siswa-siswi sekalian, kompetensi dasar yang harus kamu kuasai adalah menjelaskan pengertian laju reaksi kimia dengan menganalisis faktor-faktor yang mempengaruhi laju reaksi.
Untuk mengetahui apakah kamu telah mengerti tentang materi laju reaksi, ada indikator-indikator yang harus dapat kamu jelaskan, yaitu:
1. pengertian Laju reaksi.
2. faktor-faktor yang mempengaruhi laju reaksi.
Nah....kalian ibu beri pertanyaan: bila ada 2 buah gelas berisi air panas dan air dingin, lalu kita masukkan ke dalam masing-masing gelas tersebut sesendok gula pasir……nah, dalam gelas mana gula pasir lebih cepat larut???
Cepat atau lambatnya gula melarut (bereaksi) di dalam air adalah salah satu contoh aplikasi konsep laju reaksi dalam kehidupan sehari-hari……dan ledakan bom atom pada gambar di atas juga termasuk satu contoh reaksi kimia yang terjadi dengan kelajuan yang sangat cepat.....
Oke…..sekarang kita akan mempelajari tentang konsep laju reaksi……
KONSEP LAJU REAKSI
Bila ada suatu reaksi antara zat A dan zat B yang menghasilkan zat C seperti reaksi sbb:
aA + bB ---> cC
Maka laju reaksi dapat dinyatakan sbb:
= - 1/a delta [A] / delta t
= - 1/b delta [B] / delta t
= + 1/c delta [C] / delta t
Konsentrasi pereaksi tiap satuan waktu akan berkurang , sedangkan konsentrasi produk semakin bertambah. contoh dalam kehidupan sehari-hari: perkaratan besi, reaksi pembuatan sabun, reaksi pembuatan parfum, reaksi pada ledakan bom atom, dan lain-lain.
Contoh soal:
1. Bila diketahui suatu reaksi sbb :
A2 + B5 ---> C3
Bagaimana cara menyatakan laju reaksinya ?
Jawab :
V = - delta [A2]/ delta t
= - delta [B5]/ delta t
= + delta [C3]/ delta t
2. Bila diketahui suatu reaksi sbb :
2 NO (g) + F2 (g) ---> 2 NO2F (g)
Bagaimana cara menyatakan laju reaksinya ?
Jawab :
V = - ½ delta [NO]/ delta t
= - delta [F2]/ delta t
= + ½ delta [NO2F]/ delta t
Jadi, apa pengertian laju reaksi menurutmu...??? yaaaa....laju reaksi adalah perubahan konsentrasi reaktan (pereaksi) atau produk tiap satuan waktu.
FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
1. KONSENTRASI, pada konsentrasi tinggi, suatu zat akan lebih cepat bereaksi dibanding pada konsentrasi rendah, contohnya....seseorang yang makan buah durian matang (konsentrasi alkohol tinggi) akan lebih cepat terasa panas badannya dibanding dengan orang yang makan buah durian agak mengkal (konsentrasi alkohol rendah).
2. SUHU, pada suhu tinggi reaksi akan lebih cepat dibanding pada suhu rendah, contohnya sesendok gula pasir akan cepat larut di dalam segelas air panas dibanding dalam air dingin.
3. LUAS PERMUKAAN (LUAS BIDANG SENTUH), bila ukuran suatu zat padat semakin kecil maka luas permukaannya untuk bisa bersentuhan dengan zat lain akan lebih luas sehingga reaksi terjadi lebih cepat, contoh gula halus berbentuk tepung akan lebih cepat larut dalam air dingin di banding dengan kristal gula pasir.
4. KATALIS, penggunaan katalis pada reaksi kimia ibarat orang mengendarai mobil di jalan tol, sedangkan reaksi kimia tanpa katalis ibarat orang mengendarai mobil di jalan yang berkelok-kelok dan mendaki bukit....jadi, dengan adanya katalis reaksi kimia akan lebih cepat. Contoh katalis dalam hidup kita sehari-hari adalah enzim yang ada dalam tubuh kita seperti enzim amilase , enzim protease dan lain-lain yang membantu reaksi kimia dalam tubuh kita khususnya dalam proses pencernaan.
Nah....jelas kan apa saja yang mempengaruhi laju reaksi kimia..???
Sekarang tugasmu adalah mengerjakan soal-soal latihan pilihan ganda pada buku kimia karangan Michael Purba no. 1 s.d 10. Oke...selamat dan sukses buat kalian semua....!!
LAJU REAKSI
Dalam kehidupan sehari-hari banyak sekali kita temukan reaksi kimia yang laju reaksinya dapat diperkecil atau diperbesar.
:) Pengaruh konsentrasi terhadap laju reaksi
Apa yang kalian ketahui tentang pemakaian kaporit (CaOCl2)
untuk membersihkan kolam renang? Kaporit digunakan untuk membersihkan
kuman-kuman yang ada dalam kolam renang. Konsentrasi larutan kaporit
yang digunakan sangat menentukan kebersihan kolam renang tersebut.
Apabila konsentrasinya terlalu rendah maka larutan kaporit tersebut
tidak cukup kuat untuk eatikan kuman-kuman dalam kolam renang tersebut.
:) Pengaruh luas permukaan terhadap laju reaksi
Pernahkah
kalian memakan sate? Perhatikan potongan sate tersebut sate
dipotong-potong kecil dan tipis. Mengapa demikian? Sate dipotong tipis
untuk mendapatkan luas permukaan yang lebih luas dibanding sate yang
yang yang potongannya besar, supaya sate tersebut lebih cepat matangnya.
Dengan kata lain reaksi pematangan pada sate cepat terjadi.
:) Pengaruh temperatur pada kesetimbangan
Pernahkah
kalian pergi ke pasar ikan atau melihat ikan segar yang di jual di
supermarket? Ikan-ikan yang dijual selalu diletakkan dalam wadah yang
diberi es supaya tahan lama den tidak cepat busuk. Temperatur yang
sangat rendah akan memperlambat proses pembusukan ikan atau memperlambat
reaksi pembusukan yang disebabkan oleh bakteri-bakteri tertentu.
:) Pengaruh katalis dalam industri
Katalis
pada mesin kendaraan bermotor dikenal dengan konverter katalistik.
Katalis ini menyaring udara kotor sisa pembakaran bahan bakar yang
berupa udara kotor, seperti hidrokarbon, karbon monoksida, dan nitrogen
oksida. Di dalam konverter akan terjadi reaksi oksidasi dan reaksi
reduksi, yang menghasilkan udara bersih seperti uap air, karbon
dioksida, dan nitrogen.
Sumber: Kimia SMA/MA kelas XI terbitan Bailmu
Sumber: Kimia SMA/MA kelas XI terbitan Bailmu
Poskan judulPenerapan Laju Reaksi dalam Kehidupan Sehari-Hari
Laju reaksi itu sangat berkaitan erat dengan luas bidang permukaan, ini contoh penerapannya:
- Ibu di rumah atau pedagang bubur kacang mengiris terlebih dahulu gula merah yang akan di masukan ke dalam bubur kacang.
- Penduduk pedesaan membelah kayu gelondongan menjadi beberapa bagian sebelum dimasukkan ke dalam tungku perapian.
- Penjual gado-gado, lontong, dan pecel terlebih dulu menggerus kacang goreng sebelum dicampurkan dengan bahan lain.
- Dalam pembuatan kertas, bahan baku pembuat kertas digerus terlebih dahulu untuk membuat bubur kertas. Agar memperluas pemukaan bidang sentuh sehingga campuran menjadi homogen danreaksi berlangsung sempurna.
- Bahan baku yang sering di tambang, tersedia dalam bentuk
butir-butiran kasar. Untuk mempercepat pengolahan selanjutnya,
butiran-butiran tersebut dihancurkan sampai halus.
LAJU REAKSI
Laju merupakan ukuran perubahan sesuatu yang terjadi dalam satuan waktu.
Laju reaksi merupakan ukuran perubahan konsentrasi dalam satuan waktu
Faktor-faktor yang mempengaruhi laju reaksi adalah konsentrasi pereaksi, suhu, luas permukaan, dan katalis. Didalam industri, faktor-faktor ini sangat diperhatikan karena dapat mempengaruhi produk yang dihasilkan
A. Konsentrasi Larutan
Satuan konsentrasi larutan yang umum digunakan adalah
molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Satuan konsentrasi larutan yang umum digunakan adalah molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Sebagian besar larutan yang ditemui di laboratorium dinyatakan konsentrasinya dalam Molar (M). Secara matematis dapat dirumuskan sebagai berikut:

Jadi Molaritas atau kemolaran merupakan jumlah zat terlarut dalam tiap larutan atau jumlah dalam tiap ml (cm3) larutan
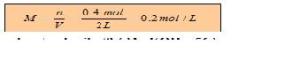
1. Berapakah kemolaran dari larutan berikut ini?
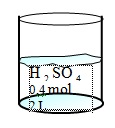
Berdasarkan contoh soal diatas, dapat dicari kemolaran H2SO4 dengan menggunakan rumus M=n/V dimana dari soal dapat diketahui jumlah mol H2SO4 yaitu 0.4 mol dan volume larutan yaitu 2 liter. Dengan menggunakan rumus kemolaran yaitu
Pengenceran larutan
Di laboratorium larutan yang berasal dari pabriknya, biasanya dalam
konsentrasi tinggi, misalnya asam klorida 12 M, dan asam asetat 17 M.
Reaksi-reaksi kimia biasanya dilakukan pada konsentrasi larutan yang rendah
misalnya 1 M atau 0,1 M. Untuk keperluan tersebut, larutan yang pekat harus
diencerkan dahulu dengan menambahkan air. Di dalam pengenceran larutan,
jumlah mol zat pada larutan pekat sama dengan larutan encer, hanya volum
larutannya yang berubah.
Jumlah mol zat terlarut dapat dihitung dengan mengalikan volum (V) dengan
molaritas larutan.
V xM = volum larutan x mol zat terlarut/volum larutan
= mol zat terlarut
Dengan demikian hasil perkalian volum dan molaritas larutan semula (V1M1)
sama dengan hasil perkalian volum dan molaritas larutan setelah pengenceran
(V2M2).

V1 = volum sebelum pengenceran
M1 = konsentrasi molar sebelum pengenceran
V2 = volum sesudah pengenceran
M2 = konsentrasi molar sesudah pengenceran
Contoh Soal
Tentukan konsentrasi larutan yang terjadi jika kedalam 10 mL Na2S2O3 0,5 M
ditambah 10 mL air!
Penyelesaian:
V1M1 = V2M2
10 mL x 05 M = 20 mL x M2
M2 = 0,25
Konsentrasi larutan setelah diencerkan = 0,25 M.
B. KONSEP LAJU REAKSI
Reaksi-reaksi kimia berlangsung dengan laju yang berbeda-beda. Ada reaksi yang berlangsung sangat cepat dan ada reaksi yang berlangsung dengan lambat. Perhatikan gambar berikut ini !
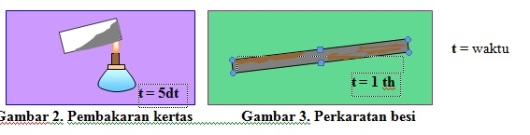
Berdasarkan gambar diatas dapat dilihat bahwa waktu yang diperlukan untuk pembakaran kertas lebih sedikit daripada waktu untuk proses perkaratan besi. Sehingga, reaksi pembakaran kertas berlangsung lebih cepat sedangkan reaksi perkaratan besi berlangsung lebih lambat.
Cepat lambatnya suatu reaksi berlangsung disebut dengan laju reaksi. Dalam kehidupan sehari-hari pengetahuan tentang laju reaksi sangat diperlukan.
Dalam suatu reaksi kimia, zat pereaksi akan bereaksi membentuk zat produk reaksi sehingga jumlah zat pereaksi akan berkurang sedangkan jumlah zat produk reaksi akan bertambah.
Perhatikan grafik berikut ini:
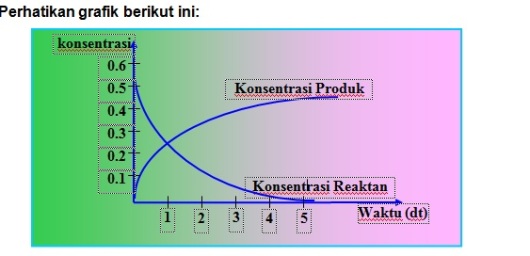
Gambar 4. Grafik Laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa semakin besar waktu maka jumlah reaktan akan …………(sedikit) sedangkan jumlah produk akan ……………(besar) Konsentrasi zat pereaksi atau produk dinyatakan dalam kemolaran (molaritas)
Oleh karena itu, laju reaksi reaktan dan produk reaksi dapat dirumuskan sbb:
contoh soal
1. Berdasarkan eksperimen pada reaksi:
H2O2 (aq) + 2HI (aq)→ 2H2O (l) + I2 (aq)
Diketahui bahwa konsentrasi I2 bertambah dari 0 menjadi 0.002 mol/L dalam 10 detik. Tentukan laju reaksi untuk reaksi tersebut !
Dari reaksi diatas dapat dilihat bahwa produk reaksi tersebut adalah I2. maka untuk mencari laju reaksi dari reaksi tersebut dapat digunakan persamaan berikut:
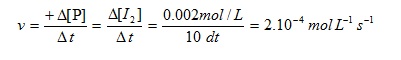
C. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
Laju reaksi akan lebih cepat terjadi jika tumbukan antar partikel zat yang bereaksi lebih banyak. Beberapa faktor-faktor yang mempengaruhi banyaknya tumbukan terlihat pada bagan berikut:

Bagan 1.Faktor yang mempengaruhi Laju Reaksi
1. PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
Perhatikan gambar berikut:
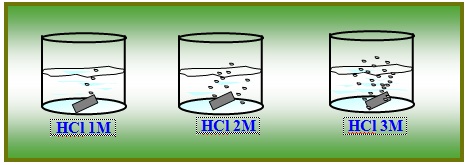
Gambar 5. reaksi pita Mg dengan HCl
Berdasarkan gambar diatas, dapat dilihat bahwa larutan HCl mempunyai berbagai konsentrasi yaitu ….. (1) M……, (2)M dan … …. (3)M
Magnesium (Mg) yang dimasukkan kedalam larutan HCl akan bereaksi dengan persamaan sebagai berikut:
Mg (s) + 2HCl (aq) →MgCl2 (aq) (4) + H2 (g)
Table.1 hasil percobaan reaksi Mg dengan HCl
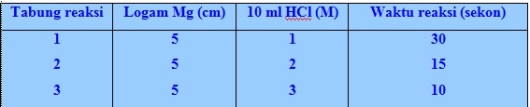
Dari data hasil percobaan yang ada pada gambar dan tabel.1 maka dapat diketahui bahwa semakin tinggi konsentrasi HCl, semakin … Mg habis bereaksi dan waktu yang diperlukan semakin kecil
Makin besar konsentrasi, laju reaksi makin cepat
2. PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI
Suatu zat akan bereaksi apabila bercampur dan bertumbukan. Reaksi dapat terjadi antara reaktan-reaktan yang fasenya sama misalnya, cair dengan cair ataupun yang fasenya berbeda cair dengan padat. Pada pencampuran reaktan yang terdiri dari dua fase atau lebih, tumbukan berlangsung pada bagian permukaan zat. Laju seperti itu, dapat diperbesar dengan memperluas permukaan sentuhan zat itu dengan cara memperkecil ukuran partikelnya.
Perhatikan percobaan berikut ini !

Gambar 6. percobaan reaksi CaCO3 dan HCl
Persamaan reaksi yang terjadi adalah sebagai berikut:
CaCO3(s) + 2HCl(aq)→ CaCl2(aq) + H2O(l) + CO2(g)
Waktu reaksi dari masing-masing percobaan adalah seperti pada table.2 berikut:
Tabel 2. laju reaksi CaCO3 dan HCl

Berdasarkan data dari table.2, dapat disimpulkan sebagai berikut:
Makin luas permukaan bidang sentuh, makin cepat laju reaksinya
3. PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
Pengaruh temperature terhadap laju reaksi dapat kita lihat dalam kehidupan sehari-hari. Misalnya makanan kentang akan lebih cepat masak jika digoreng dalam minyak panas dibandingkan jika direbus dalam air. Hal ini karena suhu minyak panas lebih tinggi dibandingkan suhu air mendidih.
Untuk lebih jelasnya tentang pengaruh temperature terhadap laju reaksi perhatikan gambar percobaan berikut ini:

Gambar 7. percobaan reaksi Na2S2O3 dan HCl
Pada gambar.8 diatas, larutan HCl 2M direaksikan dengan larutan Na2S 2O3 0.2M pada suhu yang berbeda yaitu………27°……..(37°) dan ………….(47°). Waktu reaksi dicatat sampai terbentuk endapan belerang didalam gelas kimia.
Persamaan reaksi yang terjadi adalah sebagai berikut:
Na2S2O3(aq) + HCl(aq)→ 2NaCl(aq) + H2O(l) + SO2(g) + S(s)
Dari percobaan didapatkan data sebagai berikut;
Table.3 laju reaksi Na2S2O3 dan HCl
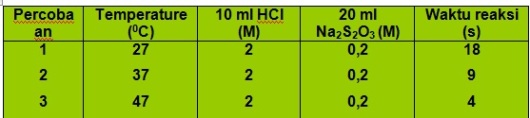
Berdasarkan gambar terlihat bahwa semakin besar temperatur semakin cepat endapan terbentuk dan dari data percobaan pada table.3 dapat dilihat bahwa semakin besar temperature, maka waktu yang diperlukan untuk mereaksikan antara HCl dan Na2S2O3 semakin kecil, berarti laju reaksi semakin cepat.
Dengan demikian dapat disimpulkan bahwa:
Makin tinggi temperatur pereaksi, makin cepat laju reaksinya.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Katalis merupakan suatu zat yang dapat mempercepat laju reaksi tanpa mengalami perubahan kimia secara permanen (kekal), sehingga di akhir reaksi zat tersebut dapat diperoleh kembali.
Untuk lebih memahami mengenai pengertian katalis, perhatikan percobaan penguraian hidrogen peroksida (H2O2) berikut ini:
2H2O2(l)→ 2H2O(l) + O2(g)
Larutan H2O2 5% masing-masing 50 ml dimasukkan kedalam tiga gelas kimia.
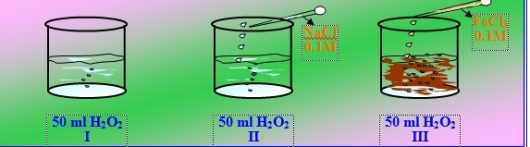
Gambar 8. Percobaan penguraian H2O2
Dari gambar diatas, dapat dilihat bahwa pada tabung I terjadi penguraian H2O2 yang ditandai dengan timbulnya sedikit gelembung. Pada tabung II H2O2 ditambah dengan NaCl 0.1M, tetapi tidak mempengaruhi proses penguraian H2O2 karena gelembung yang timbul tetap sedikit. Sedangkan pada tabung III ditambah dengan FeCl3. Pada saat ditambah dengan FeCl3 terlihat bahwa gelembung semakin banyak dan warna larutan berubah menjadi coklat.
Berdasarkan data dan hasil pengamatan diatas dapat disimpulkan sebagai berikut:
1. Pereaksi yang merupakan katalis adalah …FeCl3
2. Pereaksi yang bukan merupakan katalis adalah NaCl
3. Tanpa katalis reaksi berlangsung ………cepat
4. Dengan katalis reaksi berlangsung………lambat
Berdasarkan percobaan ini maka dapat disimpulkan katalis adalah zat yang dapat mempercepat suatu reaksi tanpa ikut bereaksi
D.TEORI TUMBUKAN
Teori tumbukan menggambarkan pertemuan partikel-partikel pereaksi sebagai suatu tumbukan. Tumbukan ada yang menghasilkan reaksi dan ada yang tidak menghasilkan reaksi. Tumbukan yang menghasilkan partikel-partikel produk reaksi disebut tumbukan efektif. Faktor-faktor yang menentukan tumbukan efektif yaitu energi kinetik partikel (molekul) dan orientasi atau arah partikel. Perhatikan reaksi antara gas Nitrogen Oksida (NO) dengan ozon (O3) berikut ini: NO (g) + O3 (g)→ NO2 (g) + O2 (g)
Berdasarkan pada gambar diatas, dari gambar (a) dapat dilihat bahwa orientasi partikel antara O dengan N tidak tepat sehingga tidak menghasilkan tumbukan efektif. Sedangkan pada gambar (b) orientasi partikel sudah tepat sehingga menghasilkan tumbukan efektif dan akan membentuk produk reaksi yaitu NO2 dan O2
Faktor-faktor yang mempengaruhi laju reaksi seperti konsentrasi, luas permukaan, suhu dan katalis berhubungan dengan tumbukan antar partikel. Mengapa demikian ? Hal ini dapat dijelaskan sebagai berikut
1.PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Perhatikan gambar berikut:
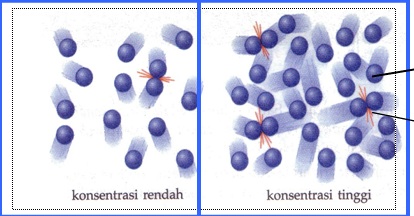
Gambar 10. pengaruh konsentrasi terhadap laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa konsentrasi pereaksi berkaitan dengan jumlah partikel zat yang terlibat dalam tumbukan. Bila pereaksi bertambah, maka jumlah partikel-partikel yang bertumbukan akan semakin banyak/meningkat. Dengan demikian jarak antara partikel.zat tersebut menjadi lebih dekat dan jumlah tumbukkan efektif juga akan meningkat. Hal ini berarti terjadi peningkatan laju suatu reaksi. Dan sebaliknya, jika konsentrasi berkurang, maka tumbukan akan sedikit dan laju reaksi juga akan berkurang.
2.PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI BERDASARKAN TEORI TUMBUKAN
Untuk massa yang sama, semakin halus bentuk suatu zat maka semakin luas permukaan zat. Berdasarkan teori tumbukan: “semakin luas permukaan partikel, semakin besar kemungkinan terjadinya tumbukan antar partikel”.
Perhatikan gambar berikut ini!

Gambar 11. pengaruh luas permukaan terhadap laju reaksi
Dari gambar 11 dapat dilihat bahwa serbuk Fe bereaksi lebih cepat dari pada batang Fe. Hal ini disebabkan karena luas permukaan serbuk Fe lebih luas daripada kepingan Fe, sehingga bidang sentuhnya lebih banyak untuk bertumbukan dengan zat lain. Akibatnya laju reaksi zat berbentuk serbuk lebih cepat daripada zat yang berbentuk kepingan.
3.PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Pengaruh temperatur terhadap laju reaksi terkait dengan energi kinetik partikel. Mengapa demikian ? Perhatikan gambar berikut ini:
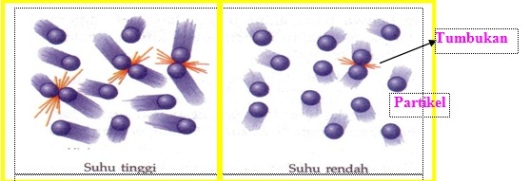
Gambar 13. tumbukan partikel pada suhu tinggi dan rendah.
Berdasarkan gambar diatas dapat dilihat bahwa pada suhu tinggi, jumlah partikel yang bertumbukan lebih banyak dibandingkan pada suhu rendah. Hal ini disebabkan karena pada suhu tinggi energi kinetik partikel akan lebih besar. Hal ini menyebabkan jumlah tumbukan semakin banyak sehingga laju reaksi akan meningkat.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Pengaruh katalis dalam mempengaruhi laju reaksi terkait dengan energi pengaktifan reaksi (Ea). Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah dibandingkan dengan nilai Ea reaksi tanpa katalis. Semakin rendah nilai Ea maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan Ea yang rendah ini. Hal ini menyebabkan jumlah tumbukan efektif akan bertambah, sehingga laju reaksi juga akan meningkat.
Katalis yang mempercepat laju reaksi disebut katalis………………….(+) atau katalis saja. Sedangkan katalis yang memperlambat laju reaksi disebut katalis……………….(-) atau lebih umum disebut Inhibitor.
Perhatikan bagan berkut ini:

Berdasarkan bagan diatas, katalis dapat dikelompokkan menjadi dua yaitu
1. katalis organik contohnya V2O5,Pt,Fe,Rh
2. katalis anorganik, contohnya renim,enzim dari ragi dan tripsin
Hubungan antara katalis dan energi pengaktifan

Gambar 14. grafik pengaruh katalis terhadap energi pengaktifan (Ea)
Dengan memperhatikan gambar.14 diatas dapat dilihat bahwa tanpa katalis, energi pengaktifan (Ea) suatu reaksi lebih banyak, sedangkan dengan menggunakan katalis, Ea menjadi lebih sedikit, sehingga laju reaksi menjadi lebih cepat. Ini berarti bahwa katalis dapat meningkatkan energi pengaktifan suatu reaksi, sehingga laju reaksi menjadi semakin besar.
E. PERSAMAAN LAJU REAKSI DAN ORDE REAKSI
Laju reaksi diperoleh berdasarkan eksperimen. Persamaan laju reaksi melibatkan konsentrasi pereaksi dan produk reaksi.
Berdasarkan bPada umumnya hubungan antara laju reaksi dengan konsentrasi zat-zat
pereaksi hanya diturunkan dari data eksperimen. Bilangan pangkat yang
menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi disebut orde
reaksi. Untuk reaksi a A + b B → c C + d D, persamaan laju reaksi ditulis:
dengan:
V = k [A]m [B]n
Orde reaksi total = m + n
Ket: v = laju reaksi
k = tetapan laju reaksi
[A] = konsentrasi zat A (M)
[B] = konsentrasi zat B (M)
m = orde reaksi terhadap A
n = orde reaksi terhadap B
Untuk lebih memahami tentang cara penentuan persamaan laju reaksi dan orde reaksi maka perhatikanlah contoh berikut ini:
Contoh soal:
2NO + 2H2 N2 + 2H2O

Tentukan:
a. Orde reaksi
b. Persamaan laju reaksi
c. Tetapan laju reaksi (k)
d. Laju reaksi jika NO 0.2 molar direaksikan dengan H2 0.2 molar.
Jawab:
Persamaan laju reaksi adalah v = k [NO]m[H2]n
a. Menentukan nilai m dan n
Untuk mencari harga m, yaitu harga reaksi terhadap NO, perhatikan data konsentrasi H2 yang tetap yaitu 1 dan 3. selanjutnya dapat dicari nilai m yaitu dengan membandingkan konsentrasi dengan nilai laju reaksi, yaitu sebagai berikut:
m = 3 dengan cara yang sama tentukanlah nilai n (orde reaksi H2) perhatikan data yang menunjukkan konsentrasi NO tetap dan H2 berubah yaitu data ……..(1) dan …….(2) sehingga dapat dicari nilai n yaitu:
n = 1Jadi Orde reaksi = m + n =3+1=4
b. Persamaan laju reaksi adalah v= k [NO]m[H2]n
V=K[NO]3[H2]
c. Tetapan laju reaksi(k)
Untuk mencari harga k, masukkan salah satu data misalnya data 1 kedalam persamaan laju reaksi.
v= k [NO]m[H2]n
V=K(0,1)3(0,1)
Laju reaksi merupakan ukuran perubahan konsentrasi dalam satuan waktu
Faktor-faktor yang mempengaruhi laju reaksi adalah konsentrasi pereaksi, suhu, luas permukaan, dan katalis. Didalam industri, faktor-faktor ini sangat diperhatikan karena dapat mempengaruhi produk yang dihasilkan
A. Konsentrasi Larutan
Satuan konsentrasi larutan yang umum digunakan adalah
molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Satuan konsentrasi larutan yang umum digunakan adalah molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Sebagian besar larutan yang ditemui di laboratorium dinyatakan konsentrasinya dalam Molar (M). Secara matematis dapat dirumuskan sebagai berikut:

Jadi Molaritas atau kemolaran merupakan jumlah zat terlarut dalam tiap larutan atau jumlah dalam tiap ml (cm3) larutan
1. Berapakah kemolaran dari larutan berikut ini?

Berdasarkan contoh soal diatas, dapat dicari kemolaran H2SO4 dengan menggunakan rumus M=n/V dimana dari soal dapat diketahui jumlah mol H2SO4 yaitu 0.4 mol dan volume larutan yaitu 2 liter. Dengan menggunakan rumus kemolaran yaitu

Pengenceran larutan
Di laboratorium larutan yang berasal dari pabriknya, biasanya dalam
konsentrasi tinggi, misalnya asam klorida 12 M, dan asam asetat 17 M.
Reaksi-reaksi kimia biasanya dilakukan pada konsentrasi larutan yang rendah
misalnya 1 M atau 0,1 M. Untuk keperluan tersebut, larutan yang pekat harus
diencerkan dahulu dengan menambahkan air. Di dalam pengenceran larutan,
jumlah mol zat pada larutan pekat sama dengan larutan encer, hanya volum
larutannya yang berubah.
Jumlah mol zat terlarut dapat dihitung dengan mengalikan volum (V) dengan
molaritas larutan.
V xM = volum larutan x mol zat terlarut/volum larutan
= mol zat terlarut
Dengan demikian hasil perkalian volum dan molaritas larutan semula (V1M1)
sama dengan hasil perkalian volum dan molaritas larutan setelah pengenceran
(V2M2).

V1 = volum sebelum pengenceran
M1 = konsentrasi molar sebelum pengenceran
V2 = volum sesudah pengenceran
M2 = konsentrasi molar sesudah pengenceran
Contoh Soal
Tentukan konsentrasi larutan yang terjadi jika kedalam 10 mL Na2S2O3 0,5 M
ditambah 10 mL air!
Penyelesaian:
V1M1 = V2M2
10 mL x 05 M = 20 mL x M2
M2 = 0,25
Konsentrasi larutan setelah diencerkan = 0,25 M.
B. KONSEP LAJU REAKSI
Reaksi-reaksi kimia berlangsung dengan laju yang berbeda-beda. Ada reaksi yang berlangsung sangat cepat dan ada reaksi yang berlangsung dengan lambat. Perhatikan gambar berikut ini !

Berdasarkan gambar diatas dapat dilihat bahwa waktu yang diperlukan untuk pembakaran kertas lebih sedikit daripada waktu untuk proses perkaratan besi. Sehingga, reaksi pembakaran kertas berlangsung lebih cepat sedangkan reaksi perkaratan besi berlangsung lebih lambat.
Cepat lambatnya suatu reaksi berlangsung disebut dengan laju reaksi. Dalam kehidupan sehari-hari pengetahuan tentang laju reaksi sangat diperlukan.
Dalam suatu reaksi kimia, zat pereaksi akan bereaksi membentuk zat produk reaksi sehingga jumlah zat pereaksi akan berkurang sedangkan jumlah zat produk reaksi akan bertambah.
Perhatikan grafik berikut ini:

Gambar 4. Grafik Laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa semakin besar waktu maka jumlah reaktan akan …………(sedikit) sedangkan jumlah produk akan ……………(besar) Konsentrasi zat pereaksi atau produk dinyatakan dalam kemolaran (molaritas)
Oleh karena itu, laju reaksi reaktan dan produk reaksi dapat dirumuskan sbb:

contoh soal
1. Berdasarkan eksperimen pada reaksi:
H2O2 (aq) + 2HI (aq)→ 2H2O (l) + I2 (aq)
Diketahui bahwa konsentrasi I2 bertambah dari 0 menjadi 0.002 mol/L dalam 10 detik. Tentukan laju reaksi untuk reaksi tersebut !
Dari reaksi diatas dapat dilihat bahwa produk reaksi tersebut adalah I2. maka untuk mencari laju reaksi dari reaksi tersebut dapat digunakan persamaan berikut:
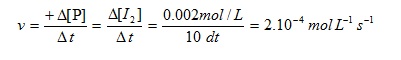
C. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
Laju reaksi akan lebih cepat terjadi jika tumbukan antar partikel zat yang bereaksi lebih banyak. Beberapa faktor-faktor yang mempengaruhi banyaknya tumbukan terlihat pada bagan berikut:

Bagan 1.Faktor yang mempengaruhi Laju Reaksi
1. PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
Perhatikan gambar berikut:

Gambar 5. reaksi pita Mg dengan HCl
Berdasarkan gambar diatas, dapat dilihat bahwa larutan HCl mempunyai berbagai konsentrasi yaitu ….. (1) M……, (2)M dan … …. (3)M
Magnesium (Mg) yang dimasukkan kedalam larutan HCl akan bereaksi dengan persamaan sebagai berikut:
Mg (s) + 2HCl (aq) →MgCl2 (aq) (4) + H2 (g)
Table.1 hasil percobaan reaksi Mg dengan HCl

Dari data hasil percobaan yang ada pada gambar dan tabel.1 maka dapat diketahui bahwa semakin tinggi konsentrasi HCl, semakin … Mg habis bereaksi dan waktu yang diperlukan semakin kecil
Makin besar konsentrasi, laju reaksi makin cepat
2. PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI
Suatu zat akan bereaksi apabila bercampur dan bertumbukan. Reaksi dapat terjadi antara reaktan-reaktan yang fasenya sama misalnya, cair dengan cair ataupun yang fasenya berbeda cair dengan padat. Pada pencampuran reaktan yang terdiri dari dua fase atau lebih, tumbukan berlangsung pada bagian permukaan zat. Laju seperti itu, dapat diperbesar dengan memperluas permukaan sentuhan zat itu dengan cara memperkecil ukuran partikelnya.
Perhatikan percobaan berikut ini !

Gambar 6. percobaan reaksi CaCO3 dan HCl
Persamaan reaksi yang terjadi adalah sebagai berikut:
CaCO3(s) + 2HCl(aq)→ CaCl2(aq) + H2O(l) + CO2(g)
Waktu reaksi dari masing-masing percobaan adalah seperti pada table.2 berikut:
Tabel 2. laju reaksi CaCO3 dan HCl

Berdasarkan data dari table.2, dapat disimpulkan sebagai berikut:
Makin luas permukaan bidang sentuh, makin cepat laju reaksinya
3. PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
Pengaruh temperature terhadap laju reaksi dapat kita lihat dalam kehidupan sehari-hari. Misalnya makanan kentang akan lebih cepat masak jika digoreng dalam minyak panas dibandingkan jika direbus dalam air. Hal ini karena suhu minyak panas lebih tinggi dibandingkan suhu air mendidih.
Untuk lebih jelasnya tentang pengaruh temperature terhadap laju reaksi perhatikan gambar percobaan berikut ini:

Gambar 7. percobaan reaksi Na2S2O3 dan HCl
Pada gambar.8 diatas, larutan HCl 2M direaksikan dengan larutan Na2S 2O3 0.2M pada suhu yang berbeda yaitu………27°……..(37°) dan ………….(47°). Waktu reaksi dicatat sampai terbentuk endapan belerang didalam gelas kimia.
Persamaan reaksi yang terjadi adalah sebagai berikut:
Na2S2O3(aq) + HCl(aq)→ 2NaCl(aq) + H2O(l) + SO2(g) + S(s)
Dari percobaan didapatkan data sebagai berikut;
Table.3 laju reaksi Na2S2O3 dan HCl

Berdasarkan gambar terlihat bahwa semakin besar temperatur semakin cepat endapan terbentuk dan dari data percobaan pada table.3 dapat dilihat bahwa semakin besar temperature, maka waktu yang diperlukan untuk mereaksikan antara HCl dan Na2S2O3 semakin kecil, berarti laju reaksi semakin cepat.
Dengan demikian dapat disimpulkan bahwa:
Makin tinggi temperatur pereaksi, makin cepat laju reaksinya.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Katalis merupakan suatu zat yang dapat mempercepat laju reaksi tanpa mengalami perubahan kimia secara permanen (kekal), sehingga di akhir reaksi zat tersebut dapat diperoleh kembali.
Untuk lebih memahami mengenai pengertian katalis, perhatikan percobaan penguraian hidrogen peroksida (H2O2) berikut ini:
2H2O2(l)→ 2H2O(l) + O2(g)
Larutan H2O2 5% masing-masing 50 ml dimasukkan kedalam tiga gelas kimia.

Gambar 8. Percobaan penguraian H2O2
Dari gambar diatas, dapat dilihat bahwa pada tabung I terjadi penguraian H2O2 yang ditandai dengan timbulnya sedikit gelembung. Pada tabung II H2O2 ditambah dengan NaCl 0.1M, tetapi tidak mempengaruhi proses penguraian H2O2 karena gelembung yang timbul tetap sedikit. Sedangkan pada tabung III ditambah dengan FeCl3. Pada saat ditambah dengan FeCl3 terlihat bahwa gelembung semakin banyak dan warna larutan berubah menjadi coklat.
Berdasarkan data dan hasil pengamatan diatas dapat disimpulkan sebagai berikut:
1. Pereaksi yang merupakan katalis adalah …FeCl3
2. Pereaksi yang bukan merupakan katalis adalah NaCl
3. Tanpa katalis reaksi berlangsung ………cepat
4. Dengan katalis reaksi berlangsung………lambat
Berdasarkan percobaan ini maka dapat disimpulkan katalis adalah zat yang dapat mempercepat suatu reaksi tanpa ikut bereaksi
D.TEORI TUMBUKAN
Teori tumbukan menggambarkan pertemuan partikel-partikel pereaksi sebagai suatu tumbukan. Tumbukan ada yang menghasilkan reaksi dan ada yang tidak menghasilkan reaksi. Tumbukan yang menghasilkan partikel-partikel produk reaksi disebut tumbukan efektif. Faktor-faktor yang menentukan tumbukan efektif yaitu energi kinetik partikel (molekul) dan orientasi atau arah partikel. Perhatikan reaksi antara gas Nitrogen Oksida (NO) dengan ozon (O3) berikut ini: NO (g) + O3 (g)→ NO2 (g) + O2 (g)
Berdasarkan pada gambar diatas, dari gambar (a) dapat dilihat bahwa orientasi partikel antara O dengan N tidak tepat sehingga tidak menghasilkan tumbukan efektif. Sedangkan pada gambar (b) orientasi partikel sudah tepat sehingga menghasilkan tumbukan efektif dan akan membentuk produk reaksi yaitu NO2 dan O2
Faktor-faktor yang mempengaruhi laju reaksi seperti konsentrasi, luas permukaan, suhu dan katalis berhubungan dengan tumbukan antar partikel. Mengapa demikian ? Hal ini dapat dijelaskan sebagai berikut
1.PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Perhatikan gambar berikut:

Gambar 10. pengaruh konsentrasi terhadap laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa konsentrasi pereaksi berkaitan dengan jumlah partikel zat yang terlibat dalam tumbukan. Bila pereaksi bertambah, maka jumlah partikel-partikel yang bertumbukan akan semakin banyak/meningkat. Dengan demikian jarak antara partikel.zat tersebut menjadi lebih dekat dan jumlah tumbukkan efektif juga akan meningkat. Hal ini berarti terjadi peningkatan laju suatu reaksi. Dan sebaliknya, jika konsentrasi berkurang, maka tumbukan akan sedikit dan laju reaksi juga akan berkurang.
2.PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI BERDASARKAN TEORI TUMBUKAN
Untuk massa yang sama, semakin halus bentuk suatu zat maka semakin luas permukaan zat. Berdasarkan teori tumbukan: “semakin luas permukaan partikel, semakin besar kemungkinan terjadinya tumbukan antar partikel”.
Perhatikan gambar berikut ini!

Gambar 11. pengaruh luas permukaan terhadap laju reaksi
Dari gambar 11 dapat dilihat bahwa serbuk Fe bereaksi lebih cepat dari pada batang Fe. Hal ini disebabkan karena luas permukaan serbuk Fe lebih luas daripada kepingan Fe, sehingga bidang sentuhnya lebih banyak untuk bertumbukan dengan zat lain. Akibatnya laju reaksi zat berbentuk serbuk lebih cepat daripada zat yang berbentuk kepingan.
3.PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Pengaruh temperatur terhadap laju reaksi terkait dengan energi kinetik partikel. Mengapa demikian ? Perhatikan gambar berikut ini:

Gambar 13. tumbukan partikel pada suhu tinggi dan rendah.
Berdasarkan gambar diatas dapat dilihat bahwa pada suhu tinggi, jumlah partikel yang bertumbukan lebih banyak dibandingkan pada suhu rendah. Hal ini disebabkan karena pada suhu tinggi energi kinetik partikel akan lebih besar. Hal ini menyebabkan jumlah tumbukan semakin banyak sehingga laju reaksi akan meningkat.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Pengaruh katalis dalam mempengaruhi laju reaksi terkait dengan energi pengaktifan reaksi (Ea). Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah dibandingkan dengan nilai Ea reaksi tanpa katalis. Semakin rendah nilai Ea maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan Ea yang rendah ini. Hal ini menyebabkan jumlah tumbukan efektif akan bertambah, sehingga laju reaksi juga akan meningkat.
Katalis yang mempercepat laju reaksi disebut katalis………………….(+) atau katalis saja. Sedangkan katalis yang memperlambat laju reaksi disebut katalis……………….(-) atau lebih umum disebut Inhibitor.
Perhatikan bagan berkut ini:

Berdasarkan bagan diatas, katalis dapat dikelompokkan menjadi dua yaitu
1. katalis organik contohnya V2O5,Pt,Fe,Rh
2. katalis anorganik, contohnya renim,enzim dari ragi dan tripsin
Hubungan antara katalis dan energi pengaktifan

Gambar 14. grafik pengaruh katalis terhadap energi pengaktifan (Ea)
Dengan memperhatikan gambar.14 diatas dapat dilihat bahwa tanpa katalis, energi pengaktifan (Ea) suatu reaksi lebih banyak, sedangkan dengan menggunakan katalis, Ea menjadi lebih sedikit, sehingga laju reaksi menjadi lebih cepat. Ini berarti bahwa katalis dapat meningkatkan energi pengaktifan suatu reaksi, sehingga laju reaksi menjadi semakin besar.
E. PERSAMAAN LAJU REAKSI DAN ORDE REAKSI
Laju reaksi diperoleh berdasarkan eksperimen. Persamaan laju reaksi melibatkan konsentrasi pereaksi dan produk reaksi.
Berdasarkan bPada umumnya hubungan antara laju reaksi dengan konsentrasi zat-zat
pereaksi hanya diturunkan dari data eksperimen. Bilangan pangkat yang
menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi disebut orde
reaksi. Untuk reaksi a A + b B → c C + d D, persamaan laju reaksi ditulis:
dengan:
V = k [A]m [B]n
Orde reaksi total = m + n
Ket: v = laju reaksi
k = tetapan laju reaksi
[A] = konsentrasi zat A (M)
[B] = konsentrasi zat B (M)
m = orde reaksi terhadap A
n = orde reaksi terhadap B
Untuk lebih memahami tentang cara penentuan persamaan laju reaksi dan orde reaksi maka perhatikanlah contoh berikut ini:
Contoh soal:
2NO + 2H2 N2 + 2H2O

Tentukan:
a. Orde reaksi
b. Persamaan laju reaksi
c. Tetapan laju reaksi (k)
d. Laju reaksi jika NO 0.2 molar direaksikan dengan H2 0.2 molar.
Jawab:
Persamaan laju reaksi adalah v = k [NO]m[H2]n
a. Menentukan nilai m dan n
Untuk mencari harga m, yaitu harga reaksi terhadap NO, perhatikan data konsentrasi H2 yang tetap yaitu 1 dan 3. selanjutnya dapat dicari nilai m yaitu dengan membandingkan konsentrasi dengan nilai laju reaksi, yaitu sebagai berikut:
m = 3 dengan cara yang sama tentukanlah nilai n (orde reaksi H2) perhatikan data yang menunjukkan konsentrasi NO tetap dan H2 berubah yaitu data ……..(1) dan …….(2) sehingga dapat dicari nilai n yaitu:
n = 1Jadi Orde reaksi = m + n =3+1=4
b. Persamaan laju reaksi adalah v= k [NO]m[H2]n
V=K[NO]3[H2]
c. Tetapan laju reaksi(k)
Untuk mencari harga k, masukkan salah satu data misalnya data 1 kedalam persamaan laju reaksi.
v= k [NO]m[H2]n
V=K(0,1)3(0,1)
Sabtu, 29 September 2012
CINTA terpisah JARAK
” Hampir satu tahun aku tak bertemu dengan sosok itu,Namanya Dina seorang gadis yang dulu pernah singgah di Hatiku.bahkan sampai kini masih membekas dalam Ingatanku Dina adalah sosok seorang gadis yang Manis,periang dan seorang pekerja keras.sebenarnya ini bukan Inginku bukan pula inginnya untuk berpisah,tetapi keadaan yang memaksa.Demi memenuhi kebutuhan Hidup keluarganya dia terpaksa menggantungkan Hubungan kami yang hampir berjalan genap setahun dia rela meninggalkan kota ini untuk pergi menuju Jakarta.dimana semua Harapan dan Impiannya terpaut dikota itu.suatu kota yang menurut gambaranku seperti Hutan rimba yang banyak dihuni mahluk buas yang saling memangsa.
———-
Awalnya hubungan kami cukup baik setelah beberapa bulan dia disana seiring jalannya waktu perlahan Dina yang kukenal mulai sedikit berubah.Hubungan kami yang Hanya berjalan melalui alat komunikasi pun berangsur-angsur mulai jarang.Hanya saja sesekali Aku mengirim sms atau menelpon Hanya untuk menanyakan kabar atau sekedar Mengingatkan untuk Makan.walaupun terkadang tidak pernah dibalas atau Handponenya tidak diangkat.Aku berusaha untuk memaklumi itu,dengan mencoba berpikir Hal yang positif.
Beberapa Hari yang lalu Aku mendapat kabar yang sangat mengembirakan Dina menelponku memberitahukan bahwa dia sekarang ada di Palembang untuk menghadiri acara keluarga.senang sekali rasanya Aku mendengar Hal itu Kesempatan ini tak ingin aku lewatkan untuk bertemu dengannya,sekaligus melepas rindu yang sudah lama tersimpan.
sore itupun kami berjanji untuk bertemu di suatu tempat Dimana tempat itu adalah tempat pertama kami bertemu dulu.sebuah Cafe kecil di pelataran pusat kota Palembang tepatnya di pinggiran tepi sungai musi.
Bergegas sengaja Aku datang lebih Awal agar dia tak lama menunggu, tepat pukul 05.00 sore aku sampai di lokasi tersebut.”Untunglah belum terlambat..” pikirku dalam Hati, sembari memesan segelas lemon tea kesukaanku sambil membayangkan seperti apa sosoknya sekarang.sesekali kulihat Jam digital yang terpampang jelas di atas jembatan megah yang bernama Ampera itu.tak terasa 20 menit sudah berlalu isi dalam gelasku pun sudah tinggal setengah tapi dina belum juga kunjung datang.sambil meneruskan lamunan Aku memandang jauh ke arah sungai yang mengalir tenang sekilas berkaca-kaca,pantulan dari cahaya mentari yang Hampir terbenam membuatnya terlihat mengagumkan Indah sekali senja sore Ini sama seperti senja waktu itu satu tahun yang lalu saat pertama kali bertemu.
“Maaf aku terlambat..”tersadar aku dari lamunan ketika suara itu menyapaku lembut dari belakang.suara itu tak asing lagi bagiku sekejap sosok itu Hadir di Hadapanku seorang gadis yang selama ini selalu kurindu.senyumnya masih manis seperti dulu wajahnya merah merona tersipu malu.membuatku hanya diam dan terpaku sejenak seakan tak percaya dengan apa yang kulihat.
kubiarkan dia duduk di hadapanku lalu kami pun mulai saling bercerita melepas rasa rindu yang dulu selalu menggebu-gebu.seperti biasa Aku selalu lebih banyak bertanya darinya sambil sesekali menatapnya.mulai dari pekerjaan sampai kehidupan disana yang aku tanyakan padanya.kuperhatikan dia tak terlalu banyak bicara hanya menjawab sesingkatnya sambil sesekali menundukkan kepala seolah ada sesuatu yang dia sembunyikan dariku.
Tak terasa Hari mulai semakin gelap dia mengajakku untuk mengakhiri pertemuan ini sambil mengangkat gelas bermaksud menghabiskan minumannya.tiba-tiba saja aku tersentak mataku tertuju pada benda itu benda berkilau yang tersemat melingkari jari manisnya sebuah cincin yang menandakan suatu Ikatan.”Apa maksud semua ini.. ? ” tanyaku dalam Hati.perasaanku berkecamuk Antara kecewa,bingung,senang dan sedih semua bercampur jadi satu
Perih rasanya seperti tertusuk duri yang begitu dalam sangat menyakitkan kucoba berusaha meyakinkan Hatiku untuk menerima kenyataan. kutarik nafas panjang lalu kuhembuskan perlahan sekarang Aku pun sadar mengapa selama ini sikapnya tidak seperti dulu dan Hari ini aku telah melihat kenyataan yang sebenarnya.Akan tetapi Aku tak pernah menyesal dengan semua ini senang bisa mengenalnya Aku bisa mendapatkan pelajaran Hidup yang sangat bemakna tentang Jarak dan waktu ternyata memang dapat merubah segalanya.
Jumat, 21 September 2012
KIMIA INTI DAN RADIOKIMIA

Kimia inti
adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan
ini disebut reaksi inti. Peluruhan radioaktif dan transmutasi inti
merupakan reaksi inti.
Radiokimia
mempelajari penggunaan teknik-teknik kimia dalam mengkaji zat
radioaktif dan pengaruh kimiawi dari radiasi zat radioaktif tersebut.
Radioaktivitas adalah fenomena pemancaran partikel dan atau radiasi elektromagnetik oleh inti yang tidak stabil secara spontan .
Semua unsur yang memiliki nomor atom lebih besar dari 83 adalah radioaktif.
Peluruhan radioaktif terjadi melalui pemancaran partikel dasar secara spontan.
Contoh: polonium-210 meluruh spontan menjadi timbal-206 dengan memancarkan sebuah partikel α
Transmutasi inti dihasilkan dari pemboman inti oleh neutron, proton, atau inti lain.
Contoh: konversi nitrogen-14 atmosfer menjadi karbon-14 dan hidrogen
Nukleon : partikel-partikel penyusun inti, yaitu proton dan neutron
Nuklida : suatu spesies nuklir tertentu, dengan lambang:
 Z = nomor atom
Z = nomor atom
A = nomor massa = jumlah proton + neutron
N = neutron, biasanya tidak ditulis karena N = A-Z
Isotop : kelompok nuklida dengan nomor atom sama
Isobar : kelompok nuklida dengan nomor massa sama
Isoton : kelompok nuklida dengan neutron sama
Partikel Dasar yang umumnya terlibat dalam reaksi inti:
|
Nama
|
Lambang
|
Nomor atom
|
Nomor massa
|
Massa (sma)
|
|
Proton
|
P atau H
|
1
|
1
|
1,00728
|
|
Neutron
|
N
|
0
|
1
|
1,00867
|
|
Elektron
|
e
|
-1
|
0
|
0,000549
|
|
Negatron
|
β
|
-1
|
0
|
0,000549
|
|
Positron
|
β
|
+1
|
0
|
0,000549
|
|
Partikel alpha
|
He atau α
|
2
|
4
|
4,00150
|
Gelombang elektromagnet yang biasa terlibat dalam reaksi inti adalah γ (gamma) dengan massa 0 dan muatan 0.
Perbandingan antara reaksi kimia dan reaksi inti
|
No
|
Reaksi kimia
|
Reaksi Inti
|
|
1
|
Atom diubah susunannya melalui pemutusan dan pembentukan ikatan
|
Unsur (atau isotop dari unsur yang sama) dikonversi dari unsur yang satu ke lainnya
|
|
2
|
Hanya elektron dalam orbital atom atau molekul yang terlibat dalam pemutusan dan pembentukan ikatan
|
Proton, neutron, elektron dan partikel dasar lain dapat saja terlibat
|
|
3
|
Reaksi diiringi dengan penyerapan atau pelepasan energi yang relatif kecil
|
Reaksi diiringi dengan penyerapan atau pelepasan energi yang sangat besar
|
|
4
|
Laju reaksi dipengaruhi oleh suhu, tekanan, katalis dan konsentrasi
|
Laju reaksi biasanya tidak dipengaruhi oleh suhu, tekanan dan katalis
|
Aturan dalam penyetaraan reaksi inti;
- Jumlah total proton ditambah neutron dalam produk dan reaktan harus sama (kekekalan nomor massa)
- Jumlah total muatan inti dalam produk dan reaktan harus sama (kekekalan nomor atom)
KESTABILAN INTI
Kestabilan
inti tidak dapat diramalkan dengan suatu aturan. Namun, ada beberapa
petunjuk empiris yang dapat digunakan untuk mengenal inti yang stabil
dan yang bersifat radioaktif/tidak stabil, yaitu:
- Semua inti yang mempunyai proton 84 atau lebih tidak stabil
- Aturan ganjil genap, yaitu inti yang mempunyai jumlah proton genap dan jumlah neutron genap lebih stabil daripada inti yang mempunyai jumlah proton dan neutron ganjil
- Bilangan sakti (magic numbers)
Nuklida yang memiliki neutron dan proton sebanyak bilangan sakti umumnya lebih stabil terhadap reaksi inti dan peluruhan radioaktif.
Bilangan tersebut adalah:
Untuk neutron : 2, 8, 20, 28, 50, 82 dan 126
Untuk proton : 2, 8, 20, 28, 50 dan 82.
Pengaruh bilangan ini untuk stabilitas inti sama dengan banyaknya elektron untuk gas mulia yang sangat stabil.
- Kestabilan inti dapat dikaitkan dengan perbandingan neutron-proton.
PITA KESTABILAN
Grafik
antara banyaknya neutron versus banyaknya proton dalam berbagai isotop
yang disebut pita kestabilan menunjukkan inti-inti yang stabil.
Inti-inti yang tidak stabil cenderung untuk menyesuaikan perbandingan
neutron terhadap proton, agar sama dengan perbandingan pada pita
kestabilan. Kebanyakan unsur radioaktif terletak di luar pita ini.

- Di atas pita kestabilan, Z <>
Untuk mencapai kestabilan :
inti memancarkan (emisi) neutron atau memancarkan partikel beta
- Di atas pita kestabilan dengan Z > 83, terjadi kelebihan neutron dan proton
Untuk mencapai kestabilan :
Inti memancarkan partikel alfa
- Di bawah pita kestabilan, Z <>
Untuk mencapai kestabilan :
Inti memancarkan positron atau menangkap elektron
ENERGI PENGIKAT INTI
Satu ukuran kuantitatif dari stabilitas inti adalah energi ikatan inti (nuclear binding energy,
yaitu energi yang diperlukan untuk memecah inti menjadi
komponen-komponennya, proton dan neutron. Kuantitas ini menyatakan
konversi massa menjadi energi yang terjadi selama berlangsungnya reaksi
inti eksotermik yang menghasilkan pembentukan inti .
Konsep
energi ikatan berkembang dari kajian sifat-sifat inti yang menunjukkan
bahwa massa inti selalu lebih rendah dibandingkan jumlah massa nukleon.
Contoh : isotop fluorine (F), intinya memiliki 9 proton, 9 elektron dan 10 neutron dengan massa atom yang terukur sebesar 18, 9984 sma.
Analisis perhitungan teoritis massa atom F:
Massa atom = (9 x massa proton) +(9 x massa elektron) + (10 x massa neutron)
= (9 x 1,00728 sma) + ( 9 x 0,000549 sma) + (10 x 1,00867)
= 19, 15708 sma
Harga
massa atom F berdasarkan perhitungan ternyata lebih besar dibandingkan
dengan massa atom terukur, dengan kelebihan massa sebesar 0,1578 sma.
Selisih antara massa atom dan jumlah massa dari proton, elektron dan neutron disebut cacat massa (mass defect).
Menurut
teori relativitas, kehilangan massa muncul sebagai energi (kalor) yang
dilepas ke lingkungan. Banyaknya energi yang dilepas dapat ditentukan
berdasarkan hubungan kesetaraan massa-energi Einstein ( E = m c2).
ΔE = Δm c2
Dengan faktor konversi : 1 kg = 6,022 x 1026 sma
1 J = 1 kg m2/s2
Untuk atom F tersebut:
ΔE =( -0,1578 sma) (3x 108 m/s)2
= (-1,43 x 1016 sma m2/s2) x (1 kg/6,022 x 1026 sma) x (1 J/1 kg m2s2)
= -2,37 x 10-11 J
Ini
merupakan banyaknya energi yang dilepas bila satu inti fluorin-19
dibentuk dari 9 proton dan 10 neutron. Energi yang diperlukan untuk
menguraikan inti menjadi proton dan neutron yang terpisah adalah sebesar -2,37 x 10-11 J. Untuk pembentukan 1 mol inti fluorin, energi yang dilepaskan adalah:
ΔE = (-2,37 x 10-11 J) (6,022 x 1023/mol)
= -1,43 x 1013 J/mol
Dengan demikian, energi ikatan inti adalah 1,43 x 1013
J/mol untuk 1 mol inti fluorin-19, yang merupakan kuantitas yang sangat
besar bila dibandingkan dengan entalpi reaksi kimia biasa yang hanya
sekitar 200 kJ.
RADIOAKTIVITAS ALAMI
Disintegrasi
inti radioaktif sering merupakan awal dari deret peluruhan radioaktif,
yaitu rangkaian reaksi inti yang akhirnya menghasilkan pembentukan
isotop stabil. Misalnya adalah deret peluruhan uranium-238 hingga
menghasilkan timbal-206 yang stabil.
Jenis-jenis peluruhan radioaktif meliputi; peluruhan(pemancaran) alfa,
peluruhan negatron, peluruhan positron, penangkapan elektron, peluruhan
gamma, pemancaran neutron, pemancaran neutron terlambat dan pembelahan
spontan.
Pembelahan
spontan hanya terjadi pada nuklida-nuklida yang sangat besar dan
membelah secara spontan menjadi dua nuklida yang massanya berbeda, misal
Cf-254 membelah spontan menjadi Mo-108 dan Ba-142 dengan memancarkan 4
neutron.
Kinetika Peluruhan Radioaktif
Semua peluruhan radioaktif mengikuti kinetika orde pertama, sehingga laju peluruhan radioaktif pada setiap waktu t adalah:
Laju peluruhan pada waktu t = λN
λ = konstanta laju orde pertama
N = banyaknya inti radioaktif pada waktu t
ln Nt/N0 = - λt
dengan waktu paruh : t1/2 = 0,693/λ
TRANSMUTASI INTI
Pada
tahun 1919, Rutherford berhasil menembak gas nitrogen dengan partikel
alfa dan menghasilkan hidrogen dan oksigen. Reaksi ini merupakan
transmutasi buatan pertama, yaitu perubahan satu unsur menjadi unsur
lain. Coba tuliskan reaksinya!
Pada
tahun 1934, Irene Joliot-Curie, berhasil membuat atom fosfor yang
bersifat radioaktif dengan menembakkan aluminium dengan sinar alfa yang
berasal dari polonium.
Beberapa contoh reaksi inti:
1) Penembakan atom litium-7 dengan proton menghasilkan 2 atom helium-4
2) Penembakan nitrogen-14 dengan neutron menghasilkan karbon-14 dan hidrogen
3) Penembakan aluminium-27 dengan proton menghasilkan magnesium-24 dan helium-4
Coba Anda tulis persamaan reaksinya!
Keaktifan (A)
Keaktifan
suatu cuplikan radioaktif dinyatakan sebagai jumlah
disintegrasi(peluruhan) per satuan waktu. Keaktifan tidak lain adalah
laju peluruhan dan berbanding lurus dengan jumlah atom yang ada.
A = λ N
Satuan keaktifan adalah Curie (Ci) yang didefinisikan sebagai keaktifan dari 3,7 x 1010 disintegrasi per detik.
Satuan SI untuk keaktifan adalah becquerel dengan lambang Bq
1 Ci = 3,7 x 1010 Bq
Keaktifan jenis adalah jumlah disintegrasi per satuan waktu per gram bahan radioaktif.
Dosis Radiasi
Untuk
menyatakan jumlah atau dosis radiasi yang diserap oleh zat-zat
ditetapkan satuan untuk dosis. Di Amerika, satuan dosis yang umum adalah
rad dengan lambang rd.
Satu rad setara dengan penyerapan 10-5 J per gram jaringan.
Satuan SI untuk dosis adalah gray dengan lambang Gy. Satu gray setara dengan energi sebanyak 1 joule yang diserap oleh setiap kg zat.
Radiasi
neutron lebih berbahaya dari radiasi beta dengan energi dan intensitas
yang sama. Untuk membedakan pengaruh radiasi digunakan satuan rem (radiation equivalen of man).
Satu rad sinar alfa lebih merusak daripada satu rad sinar beta.
Oleh karena itu rad biasanya dikalikan dengan faktor yang mengukur
kerusakan biologi relatif yang disebabkan oleh radiasi. Faktor ini
disebut RBE (Relative Biologycal Effetiveness of Radiation). Hasil kali rad dan RBE menghasilkan dosis efektif yang disebut rem (Rontgen Equivalent for Man).
Satu rem suatu macam radiasi akan menghasilkan pengaruh biologi yang sama.
Contoh:
Dosis 0 – 20 rem pengaruh kliniknya tidak terdeteksi , dosis 20-50 sedikit pengaruh pengurangan sementara
butir darah putih, dosis 100-200 terdapat pengaruh banyak pengurangan
butir darah putih dan pada dosis lebih dari 500 rem dapat menyebabkan
kematian.
FISI INTI
Fisi inti (nuclear fission) /reaksi fisi adalah proses di mana suatu inti berat (nomor
massa >200) membelah diri membentuk inti-inti yang lebih kecil
dengan massa menengah dan satu atau lebih neutron. Karena inti berat
kurang stabil dibandingkan produknya, proses ini melepaskan banyak
energi.
Reaksi fisi uranium-235:
Sebagai
contoh adalah energi yang dihasilkan pada pembelahan 235 gram
uranium-235 adalah ekivalen dengan energi yang dihasilkan pada
pembakaran 500 ton batubara.
Selain
besarnya jumlah energi yang besar, ciri penting dari fisi uranium-235
adalah adanya kenyataan bahwa lebih banyak neutron yang dihasilkan
dibandingkan dengan yang semula ditangkap dalam prosesnya. Sifat ini
memungkinkan berlangsungnya reaksi rantai inti, yaitu serangkaian reaksi
fisi yang dapat berlangsung sendiri tanpa bantuan. Neutron yang
dihasilkan selama tahap awal dari fisi dapat mengakibatkan terjadinya
fisi dalam inti uranium-235 lain, yang selanjutnya menghasilkan neutron
lebih banyak dan seterusnya. Dalam waktu kurang dari satu detik, reaksi
dapat menjadi tak terkendali, membebaskan banyak sekali kalor ke
lingkungan. Agar reaksi rantai terjadi, harus ada cukup uranium-235
dalam sampel untuk menangkap neutron, sehingga dikenal istilah massa kritis, yaitu massa minimum material terfisikan yang diperlukan untuk membangkitkan reaksi rantai inti yang dapat berlangsung sendiri.
APLIKASI FISI INTI
Bom Atom
Penerapan
pertamakali fisi inti ialah dalam pengembangan bom atom. Faktor krusial
dalam rancangan bom ini adalah penentuan massa kritis untuk bom itu.
Satu bom atom yang kecil setara dengan 20.000 ton TNT. Massa kritis
suatu bom atom biasanya dibentuk dengan menggunakan bahan peledak
konvensional seperti TNT tersebut, untuk memaksa bagian-bagian
terfisikan menjadi bersatu. Bahan yang pertama diledakkan adalah TNT,
sehingga ledakan akan mendorong bagian-bagian yang terfisikan untuk
bersama-sama membentuk jumlah yang lebih besar dibandingkan massa
kritis.
Uranium-235
adalah bahan terfisikan dalam bom yang dijatuhkan di Hiroshima dan
plutonium-239 digunakan dalam bom yang meledak di Nagasaki.
Reaktor Nuklir
Suatu
penerapan damai tetapi kontroversial dari fisi inti adalah pembangkitan
listrik menggunakan kalor yang dihasilkan dari reaksi rantai terbatas
yang dilakukan dalam suatu reaktor nuklir. Ada 3 jenis reaktor nuklir
yang dikenal, yaitu:
- Reaktor air ringan. Menggunakan air ringan (H2O) sebagai moderator (zat yang dapat mengurangi energi kinetik neutron).
- Reaktor air berat. Menggunakan D2O sebagai moderator.
- Reaktor Pembiak (Breeder Reactor). Menggunakan bahan bakar uranium, tetapi tidak seperti reaktor nuklir konvensional, reaktor ini menghasilkan bahan terfisikan lebih banyak daripada yang digunakan.
FUSI INTI
Fusi inti (nuclear fusion)
atau reaksi fusi adalah proses penggabungan inti kecil menjadi inti
yang lebih besar. Reaksi ini relatif terbebas dari masalah pembuangan
limbah.
Dasar
bagi penelitian pemakaian fusi inti untuk produksi energi adalah
perilaku yang diperlihatkan jika dua inti ringan bergabung atau berfusi
membentuk inti yang lebih besar dan lebih stabil, banyak energi yang
akan dilepas selama prosesnya.
Fusi inti yang terus-menerus terjadi di matahari yang terutama tersusun atas hidrogen dan helium.
Reaksi fusi hanya terjadi pada suhu yang sangat tinggi sehingga reaksi ini sering dinamakan reaksi termonuklir. Suhu di bagian dalam matahari mencapai 15 jutaoC!!!!!!
Aplikasi Fusi Inti yang telah dikembangkan adalah bom hidrogen.
PENGGUNAAN RADIOISOTOP
Radioisotop
adalah isotop suatu unsur yang radioaktif yang memancarkan sinar
radioaktif. Isotop suatu unsur baik yang stabil maupun radioaktif
memiliki sifat kimia yang sama.
Radioisotop
dapat digunakan sebagai perunut (untuk mengikuti unsur dalam suatu
proses yang menyangkut senyawa atau sekelompok senyawa) dan sebagai
sumber radiasi /sumber sinar.
Berikut beberapa contoh penggunaan radioisotop dalam berbagai bidang:
1. Bidang kimia
Teknik perunut dapat dipakai untuk mempelajari mekanisme berbagai reaksi kimia seperti esterifikasi dan fotosintesis.
Penetapan struktur senyawa kimia seperti ion tiosulfat.
Analisis
pengenceran isotop dan analisis pengaktifan neutron (dalam bidang
perminyakan, pengendalian polusi, obat-obatan, geologi, elektronika,
kriminologi, oseanografi dan arkeologi).
2. Bidang kedokteran
Isotop natrium-24 digunakan untuk mengikuti
peredaran darah dalam tubuh manusia , mempelajari kelainan pada
kelenjar tiroid dengan isotop I-131, menentukan tempat tumor otak dengan
radioisotop fosfor, Fe-59 untuk mengukur laju pembentukan sel darah
merah. Kobalt-60 digunakan untuk pengobatan kanker, teknetium-99 untuk
alat diagnostik gambaran jantung, hati dan paru-paru pasien.
3. Bidang pertanian
Radiasi
gamma dapat digunakan untuk memperoleh bibit unggul dan radiisotop
fosfor untuk mempelajari pemakaian pupuk oleh tanaman.
4. Bidang Industri
Untuk
mendeteksi kebocoran pipa yang ditanam dalam tanah atau beton,
menentukan keausan atau keroposan yang terjadi pada bagian pengelasan
antar logam,
5. Penentuan umur batuan atau fosil
source: antunikimia.blogspot.com
Langganan:
Postingan (Atom)